题目内容
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
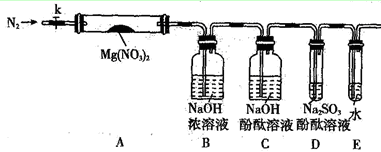
Ⅰ、硬质玻璃管常作为气体和固体反应的场所,如图(其他装置省略,必要时可加热)。
下列实验描述不正确的是
| A.固体A为无水硫酸铜时,可以检验气体X中是否含有水蒸气 |
| B.固体A为铜时,可以除去N2中的O2 |
| C.在空气流作用下,加热氯化铁晶体得到纯净的无水氯化铁 |
| D.将氨气和空气混合气通过灼热的铂丝,可看到有红棕色气体生成 |
a、b、c三个棉球变化如下表。请填写表中的空白:
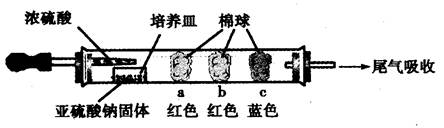
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 性 |
Ⅰ、C Ⅱ棉球 棉球上滴加的试剂 实验现象 解释和结论 a 品红试液
b 离子方程式:
2OHˉ+SO2=SO32ˉ+H2O c 含淀粉的碘水
结论:该气体具有 还原 性
解析试题分析:C、在空气流作用下,加热氯化铁晶体得到纯净的氢氧化铁,考虑Fe3+水解。
(1)a:品红溶液;SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红;
b:含酚酞的NaOH溶液,遇SO2反应,红色退去。
c:碘与淀粉的混合溶液;还原
考点:硬质玻璃管的微型试验和SO2的性质。

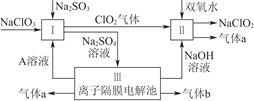
Na2SO3是常用的抗氧剂。
(1)实验室通常用浓硫酸(1:1)和Na2SO3微热制备SO2气体,
反应方程式为: ,制备的SO2气体中通常含有水蒸气,下列干燥剂能干燥SO2气体的是: ;
A.浓硫酸 B.碱石灰 C.无水CaCl2
(2) 少量SO2气体通入NaOH溶液中可得NaOH和Na2SO3的混合溶液,向该混合溶液中加入少许溴水,振荡后溶液变为无色。碱性溶液中Br2与Na2SO3发生氧化还原反应,反应的离子方程式为______________;
(3)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告;
限选试剂:2 mol·L-1HCl;1 mol·L-1H2SO4;1mol·L-1HNO3;1 mol·L-1BaCl2;
1 mol·L-1Ba(NO3)2;0.1 mol·L-1AgNO3;CCl4;苯;新制饱和溴水;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管A中,滴加2 mol·L-1HCl至溶液呈酸性,加入几滴________(填试剂),振荡 | ________,证明待测液中含SO32- |
| 步骤② | 另取少量待测液于试管B中,加入 ,再滴加适量 1 mol·L-1 BaCl2溶液 | |
| 步骤③ | 另取少量待测液于试管C中, ,振荡,静置后观察颜色 | 溶液分层,上层液体呈橙红色,证明待测液中很Br- |
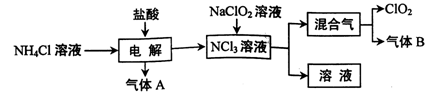
氯气的用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅等。
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是 。
(2)工业上生产半导体材料硅的流程如下:
①写出制备粗硅时反应的化学方程式: 。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点、难挥发性液态杂质,必须进行分离提纯,其提纯方法为 (填字母)。
| A.蒸馏 | B.过滤 | C.萃取 | D.结晶 |
 2KNO2+O2↑
2KNO2+O2↑ 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑ 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑