题目内容
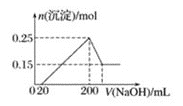
【题目】将一定质量的Mg和Al的混合物投入![]() 的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示。则下列说法正确的是
的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示。则下列说法正确的是![]()
![]()
A.Mg、Al的混合物与![]() 的稀硫酸恰好完全反应
的稀硫酸恰好完全反应
B.生成![]() 的体积为
的体积为![]()
C.当加入20mL氢氧化钠溶液时,溶液中的溶质只有硫酸镁和硫酸铝
D.NaOH溶液的物质的量浓度为![]()
【答案】D
【解析】
由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的![]() 倍.从200mL开始,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol。
倍.从200mL开始,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol。
A、根据图象知,当加入氢氧化钠溶液体积小于![]() 时,无沉淀生成,说明硫酸过量,故A错误;
时,无沉淀生成,说明硫酸过量,故A错误;
B、根据图象知,溶解的沉淀为氢氧化铝,![]() ,根据铝原子守恒知
,根据铝原子守恒知![]() ,未溶解的沉淀是氢氧化镁,
,未溶解的沉淀是氢氧化镁,![]() ,根据镁原子守恒知
,根据镁原子守恒知![]() ,根据电子守恒,生成氢气的物质的量为:
,根据电子守恒,生成氢气的物质的量为:![]() ,标准状况下
,标准状况下![]() 氢气的体积为:
氢气的体积为:![]() ,由于没有说明在标准状况下,则氢气的体积不一定为
,由于没有说明在标准状况下,则氢气的体积不一定为![]() ,故B错误;
,故B错误;
C、当加入20mL氢氧化钠溶液时,此时溶质为硫酸钠、硫酸铝和硫酸镁,故C错误;
D、当加入200mL氢氧化钠溶液时,此时溶质为硫酸钠,根据钠离子守恒及硫酸的物质的量可知氢氧化钠的物质的量为:![]() ,该氢氧化钠溶液的浓度为:
,该氢氧化钠溶液的浓度为:![]() ,故D正确;
,故D正确;
答案选D。