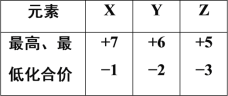题目内容
【题目】某矿物样品(已经剔除其它杂质)含三种氧化物:Al2O3、Fe2O3、CuO,化学兴趣小组欲将三种金属化合物加以分离,最终制得相应的纯净化合物或溶液。实验方案大致如下:
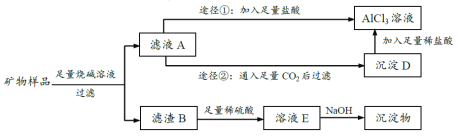
(1)纯Fe2O3、CuO的颜色依次是________色、________色。
(2)写出滤液A的主要溶质成分______________________________。
(3)由滤液A制AlCl3溶液有①和②两种途径,②与①相比自有其合理之处,理由是________。
(4)溶液E中含有三种阳离子。向E中分步滴加NaOH溶液,三种阳离子先后与OH-结合,其中列第二位的阳离子能使某种试剂变为血红色,这种试剂是_________。
(5)若矿物样品的质量为m1,所得Fe(OH)3的质量为m2,则样品中Fe2O3的质量分数为________。若使Fe3+沉淀这一步加入的NaOH过量,该测定值将______(填“偏高”、“偏低”或“不变”))。
(6)将Cu(OH)2溶于稀硫酸,然后制成胆矾晶体,必要的操作步骤依次包括:蒸发浓缩、_______、________、洗涤、自然干燥等。
【答案】红 黑 NaAlO2、NaOH ②的溶液更纯,不含Na+ KSCN ![]() 偏高 冷却结晶 过滤
偏高 冷却结晶 过滤
【解析】
矿物样品(已经剔除其它杂质)含三种氧化物:Al2O3、Fe2O3、CuO,加入足量烧碱溶液过滤,氧化铝溶解生成偏铝酸钠,氧化铁和氧化铜不溶解,滤液A为NaAlO2和氢氧化钠,滤渣B为Fe2O3、CuO,加入足量稀硫酸溶解得到硫酸铁、硫酸铜溶液E,加入氢氧化钠溶液,依次生成沉淀氢氧化铁和氢氧化铜,滤液A加入足量盐酸生成氯化铝溶液,滤液A通入足量二氧化碳过滤得到氢氧化铝沉淀D,氢氧化铝沉淀中加入足量稀盐酸得到氯化铝溶液。
(1)纯Fe2O3是红色粉末、CuO是黑色粉末;
(2)Al2O3、Fe2O3、CuO中加入足量烧碱溶液过滤,氧化铝溶解生成偏铝酸钠,氧化铁和氧化铜不溶解,所以滤液A的主要溶质成分为剩余的氢氧化钠和生成的偏铝酸钠,化学式为: NaAlO2、NaOH;
(3)途径①是偏铝酸钠与足量盐酸反应生成氯化铝和水,发生反应NaAlO2+4HCl=AlCl3+NaCl+2H2O,会引入氯化钠杂质;途径②是偏铝酸钠与足量二氧化碳反应生成氢氧化铝沉淀和氯化钠,过滤后,氢氧化铝与盐酸反应生成氯化铝和水,所以②的溶液更纯,不含Na+;
(4)溶液E中含有的三种阳离子为H+、Fe3+、Cu2+,向E中分步滴加NaOH溶液,三种阳离子先后与OH-结合, Fe3+能使KSCN溶液变为血红色,故该试剂为KSCN;
(5)Fe(OH)3的物质的量是![]() mol,根据铁元素守恒,氧化铁的物质的量是
mol,根据铁元素守恒,氧化铁的物质的量是![]() mol,氧化铁的质量是
mol,氧化铁的质量是![]()
![]() ,氧化铁的质量分数=
,氧化铁的质量分数=![]()
![]() ;若使Fe3+沉淀这一步加入的NaOH过量会生成氢氧化铜沉淀,沉淀质量增大,计算得到氧化铁质量分数会偏高;
;若使Fe3+沉淀这一步加入的NaOH过量会生成氢氧化铜沉淀,沉淀质量增大,计算得到氧化铁质量分数会偏高;
(6)由溶液制取晶体,需经过加热浓缩、冷却结晶、过滤、洗涤、干燥等步骤,将Cu(OH)2溶于稀硫酸,制成胆矾晶体,必要的操作步骤依次包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案