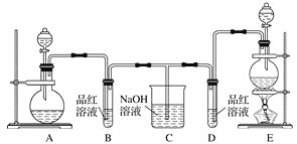
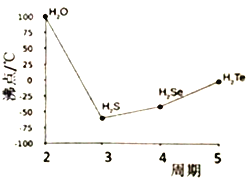
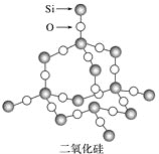
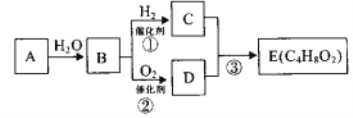
题目内容
【题目】已知有下图所示物质相互转换关系

试回答:
(1)写出B的化学式__________,D的化学式__________;
(2)写出由E转变成F的化学方程式__________;
(3)向G溶液中加入A的离子方程式__________;
向G溶液中加入铜片的离子方程式__________;
(4)简述B溶液中阳离子的检验方法__________。
【答案】(1)FeCl2 KCl(2)4Fe(OH)2+O2+2H2O═4Fe(OH)3 (3)2Fe3++Fe═3Fe2+ 2Fe3++Cu═2Fe2++Cu2+
(4)取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+
【解析】
试题根据框图E转化为F的明显现象,可确定E为氢氧化亚铁,F是氢氧化铁,所以G是氯化铁,I溶液的焰色反应呈紫色,说明I中含有钾离子,含有钾离子的盐D和硝酸银反应生成白色沉淀H一定是氯化银,所以D是氯化钾,进而推得A是金属铁,B是氯化亚铁,C是氢氧化钾.(1)B是氯化亚铁,D是氯化钾;(2)氢氧化亚铁在空气中会迅速被氧气氧化为红褐色的氢氧化铁,现象是白色沉淀迅速变灰绿色,灰绿色变成红褐色,反应原理为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;(3)金属铁和三价铁之间的反应为:2Fe3++Fe═3Fe2+,铜与Fe3+反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+;(4)亚铁离子易被氧化为三价铁,溶液中是否含有亚铁离子的检验方法:取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+。

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 应前2min的平均速率v(Z)=2.0x10-3mol(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大