题目内容
氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 |
| D.生成1molN2有6mol电子转移 |
C
解析试题分析:A.若管道漏气,逸出的氯气就会发生反应:3Cl2+2NH3=N2+6HCl;HCl+ NH3= NH4Cl。产生白色固体NH4Cl。因此遇氨就会产生白烟。正确。B.在该反应中Cl元素的化合价由0→-1,化合价降低,得到电子,被还原,作氧化剂。因此利用了Cl2的强氧化性。正确。C.因为有元素的化合价变化,所以是氧化还原反应。所有的复分解反应都不是氧化还原反应。错误。D.氧化还原反应的实质是电子转移,特征是化合价的升降。在氧化还原反应中化合价升高或降低的总数与电子转移的数目相等。有方程式可以看出生成1molN2,化合价变化数值是6,因此有6mol电子转移。正确。
考点:考查氯气的化学性质及应用的知识。

有Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
| A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl- |
| B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3 |
| D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-) |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
| A.氧化性(酸性溶液):FeCl3>Co(OH)3>I2 |
| B.还原性(碱性溶液):Fe(OH)2>I2>KIO3 |
| C.热稳定性:NaCl>NaClO4>NaClO |
| D.酸性(水溶液):HSCN>H2CO3>HCN |
已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O=10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
| A.反应Ⅰ中HCl是氧化剂 |
| B.反应Ⅱ中Cl2发生氧化反应 |
| C.还原性:CoCl2>HCl>I2 |
| D.氧化性:Co2O3>Cl2>HIO3 |
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6 mol Cl2完全反应,则被氧化的OCN-的物质的量是 ( )。
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是 ( )。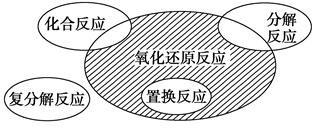
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害。其在酸性条件
下会产生NO和NO2。下列有关说法错误的是( )
| A.NaNO2既具有氧化性又具有还原性 |
| B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 |
| C.NaNO2和胃酸作用的离子方程式为: 2NO2—+2H+=NO↑+NO2↑+H2O |
| D.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol |
把7.2 g铁粉投入某硝酸溶液中,充分反应剩余固体1.6 g,产生NO2和NO的混合气体0.08 mol。若不考虑N2O4的存在,则原HNO3溶液中HNO3的物质的量为( )
| A.0.34 mol | B.0.38 mol |
| C.0.28 mol | D.0.2 mol |