题目内容
已知反应:Na2O2 + SO2 = Na2SO4,则下列判断正确的是
| A.硫元素被还原 |
| B.二氧化硫是还原剂 |
| C.过氧化钠既是氧化剂又是还原剂 |
| D.二氧化硫既不是氧化剂也不是还原剂 |
B
解析试题分析:Na2O2 + SO2 = Na2SO4,Na2O2中-1价的氧降到-2价的氧,被还原,Na2O2作氧化剂,SO2中+4价的氧升到硫酸钠中+6价的氧,被氧化,SO2作还原剂,因此B正确。
考点:考查基本实验操作

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是( )
| A.X是H2SO4 |
| B.反应中Mn原子与Bi原子个数比为5:2 |
| C.该反应中NaBiO3作氧化剂 |
| D.该反应中Na2SO4既不是氧化产物,又不是还原产物 |
下列试剂不会因为空气中的氧气而变质的是
| A.过氧化钠 | B.氢硫酸 | C.硫酸亚铁 | D.苯酚 |
下列关于甲、乙、丙、丁四个图像的说法中,正确的是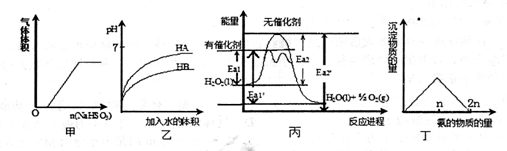
| A.甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图像 |
| B.乙是等pH的HA和HB两种弱酸溶液稀释时pH变化图,由此可知HA的酸性弱于HB |
| C.由丙可知,双氧水在有催化剂存在时的热化学方程式为 2H2O2(1)="2H" 2O(l)+O2(g) △H=-2(Ea2’-Ea2) kJ·mol-l |
| D.丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图 |
下列过程一定涉及氧化还原反应的是( )
| A.萃取 | B.电解 | C.净水 | D.分馏 |
有Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
| A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl- |
| B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3 |
| D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-) |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为
| A.1:6 |
| B.2:15 |
| C.2:11 |
| D.1:7 |
下列叙述不正确的是
| A.Li+中含有的中子数与电子数之比为2︰1 |
| B.在C2H6分子中极性共价键与非极性共价键数之比为6︰1 |
| C.常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1 |
| D.5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1 |