题目内容
7.下面是我们熟悉的物质:①O2 ②CO2 ③CaCl2 ④H2SO4 ⑤NH4Cl ⑥CH4 ⑦NaOH ⑧Ar;按下列要求回答(填序号)(1)这些物质中,属于共价化合物的是②④⑥;属于离子化合物的是③⑤⑦.
(2)这些物质中,不含化学键的是⑧;只含离子键的是③;
(3)由非金属元素之间形成的离子化合物是⑤.
分析 (1)只含共价键的化合物是共价化合物,含有离子键的化合物是离子化合物;
(2)单原子分子中不含化学键;一般来说活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(3)由非金属元素N、H可组成铵根离子,含有铵根离子的化合物为离子化合物.
解答 解:①O2 中O原子之间只存在非极性共价键,为单质;
②CO2 中存在两个碳氧双键,只存在共价键,属于共价化合物;
③CaCl2 中钙离子和氯离子之间只存在离子键,为离子化合物;
④H2SO4中S原子和O原子、O原子和H原子之间存在共价键,为共价化合物;
⑤NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,为离子化合物;
⑥CH4 中只存在C-H共价键,为共价化合物;
⑦NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,为离子化合物;
⑧Ar为单原子分子,不存在化学键;
(1)通过以上分析知,属于共价化合物的是②④⑥,属于离子化合物的是③⑤⑦,
故答案为:②④⑥、③⑤⑦;
(2)不存在化学键的是⑧Ar,只含离子键的是③CaCl2,
故答案为:⑧;③;
(3)由非金属元素N、H可组成铵根离子,由非金属元素之间形成的离子化合物是⑤NH4Cl,
故答案为:⑤.
点评 本题考查化学键,为高频考点,把握化学键的形成、判断的一般规律及常见物质中的化学键为解答的关键,侧重分析与应用能力的考查,稀有气体中不存在化学键,为易错点,题目难度不大.

练习册系列答案
相关题目
17.有关下列实验操作和相应的离子方程式的说法正确的是( )
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
18.下列关于硫酸性质的描述中,正确的是( )
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 在受热的情况下浓硫酸也不与铁、铝发生反应 |
2.等质量的下列烃完全燃烧,消耗O2最多的是( )
| A. | C2H6 | B. | CH4 | C. | C2H4 | D. | C5H12 |
19.在一密闭容器内使0.4mol甲烷和适量氯气恰好完全发生取代反应,并生成相同量的四种有机取代物,当恢复到室温时,该容器内的气体的物质的量为(不考虑气体的溶解和液体的蒸发)( )
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
16.下列有关化学用语或名称,表达正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: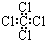 | D. | 乙烯的结构简式:CH2CH2 |
11.已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,由此可知,由1mol Cl2和1mol H2生成2mol HCl的反应过程中( )
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
 .
.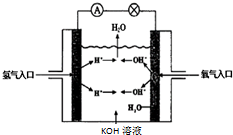 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题: