题目内容
20.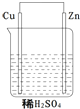 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )①电子由铜流向锌
②正极反应式为Cu+2e-=Cu2+
③SO42-向铜极移动
④铜电极上有气泡
⑤若有0.5mole-流经导线,则可产生0.25molH2
⑥烧杯中溶液的PH升高.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
分析 原电池中,活泼金属作负极,负极发生氧化反应,正极发生还原反应,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,原电池中电子由负极流向正极.
解答 解:①电流由铜流向锌,电子流向相反,故错误;
②正极反应式为2H++2e-=H2↑,故错误;
③SO42-向锌极移动,故错误;
④铜电极为正极,电极反应式为2H++2e-=H2↑,故正确;
⑤由2H++2e-=H2↑反应式可知有2mole-流经导线,则可产生1molH2,所以若有0.5mole-流经导线,则可产生0.25molH2,故正确;
⑥氢离子浓度减小,所以烧杯中溶液的PH升高,故正确;
所以④⑤⑥正确,
故选B.
点评 本题考查原电池,利用氧化还原反应来分析电极反应是解答本题的关键,并熟悉工作原理来解答,难度不大.

练习册系列答案
相关题目
16.下列有关化学用语或名称,表达正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: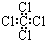 | D. | 乙烯的结构简式:CH2CH2 |
11.已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,由此可知,由1mol Cl2和1mol H2生成2mol HCl的反应过程中( )
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
8.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.7×10-13.现有甲、乙两种溶液:甲溶液为1.0×10-2mol/L的AgNO3溶液,乙溶液为1.0×10-2mol/L的NaCl溶液和1.0×10-2mol/L 的NaBr的混合溶液.按以下两种步骤进行实验:①把少量甲溶液滴加到乙溶液中;②把少量乙溶液滴加到甲溶液中.下列说法正确的是( )
| A. | ①可能形成AgBr沉淀 | B. | ①一定能有效分离Cl-与Br- | ||
| C. | ②一定不能形成AgCl沉淀 | D. | ②一定能有效分离Cl-与Br- |
15.三种主族非金属元素X、Y、Z在周期表中的位置如图所示,则下列说法中错误的是( )
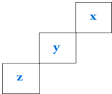

| A. | 元素Z一定是长周期元素,且既有金属性又有非金属性 | |
| B. | 三种元素中X元素的最高价氧化物对应的水化物酸性最强 | |
| C. | 三种元素中X元素的气态氢化物还原性最弱 | |
| D. | Y元素可形成多种不同的单质 |
12.镁粉是制造烟花的重要原料之一,生产镁粉时,将镁蒸气在某种气体中冷却,下列气可作为冷却气的是( )
| A. | 空气 | B. | 氮气 | C. | 氩气 | D. | 二氧化碳 |
9.下列图示的装置不属于原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
10.短周期元素的简单离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 元素非金属性:Y>Z | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子半径:X+<Z- |