题目内容
如图是用氢氧燃料电池电解氯化钠溶液(均为惰性电极),下列说法正确的是 ( )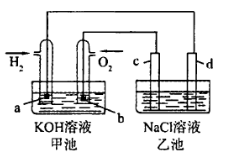
| | 甲池 | 乙池 |
| A | 放电过程中氢氧化钾浓度不变 | 滴加酚酞试液d区域溶液先变红 |
| B | 氢氧根向a极移动 | 氢氧根移向d极 |
| C | a电极消耗2.24L氢气时 | c电极生成1.12L氧气 |
| D | a电极反应:H2 -2e- =2H+ | d电极反应:4OH- -4e-=O2 + 2H2O |
C
解析试题分析:A中甲池是原电池装置,由于生成了水,碱性降低,浓度变小,描述错误,乙池中d是阴极,氢离子放电,阴极区氢氧根浓度较大,呈碱性,A错误;B中甲池描述正确,乙池中氢氢根移向阳极,错误;D中在碱性环境中电极反应式不能出现氢离子,错误。选C。
考点:本题考查电解池和原电池联合工作的原理。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如下图所示,该电池放电时,右槽中的电极反应为:V2+ - e- = V3+,下列说法正确的是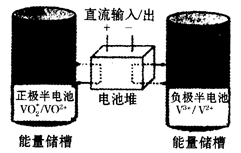
| A.放电时,右槽发生还原反应 |
| B.充电时,阴极电解液pH升高 |
| C.充电时,每转移lmol电子,n(H+)的变化量为l mol |
| D.放电时,左槽的电极反应式:VO2++ 2H+ + e-= VO2++ H2O |
瑞典ASES公司设计的用于驱动潜艇的液氨-液氧燃料 电池示意图如下,有关说法正确的是
| A.电池总反应为:4NH3 + 3O2 = N2 + 6H2O |
| B.电池工作时,OH-向负极移动 |
| C.电极2发生的电极反应为:O2+4H+ + 4e-=2H2O |
| D.电流由电极1经外电路流向电极2 |
下列描述中,不符合生产实际的是
| A.电解法精炼粗铜,用纯铜作阴极 |
| B.电解熔融的氯化钠制取金属钠,用铁作阳极 |
| C.在镀件上电镀锌,用锌作阳极 |
| D.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
在电解水制取H2和O2时,为了增强导电性常常要加入一些电解质,最好选用
| A.NaOH | B.HCl | C.NaCl | D.CuSO4 |
如图为一原电池的结构示意图,下列说法中,不正确的是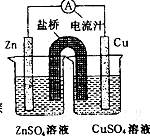
| A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| B.原电池工作时,Zn电极流出电子,发生氧化反应 |
| C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深 |
| D.盐桥中阳离子流向CuSO4溶液中 |
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
AlAg2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是( )。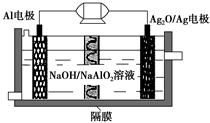
| A.工作时正极发生还原反应 |
| B.当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol |
| C.Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O |
| D.工作时电解液中的Na+透过隔膜移向Al电极 |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是 ( )。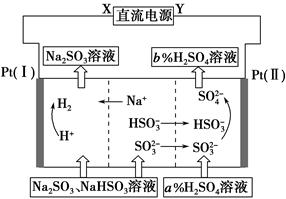
| A.X为直流电源的正极,Y为直流电源的负极 |
| B.阴极的电极反应式为2H++2e-=H2↑ |
| C.该过程中的产品主要为H2SO4和H2 |
| D.图中的b>a |