题目内容
如图为一原电池的结构示意图,下列说法中,不正确的是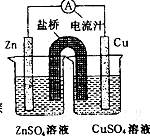
| A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| B.原电池工作时,Zn电极流出电子,发生氧化反应 |
| C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深 |
| D.盐桥中阳离子流向CuSO4溶液中 |
C
解析试题分析:A、锌的金属性强于铜,根据装置图可知,锌是负极,电极反应式为Zn-2e-=Zn2+。铜是正极,溶液中的铜离子得到电子,电极反应式为Cu2++2e-=Cu,所以总的反应式为Zn+Cu2+=Zn2++Cu,A正确;B、锌是负极,铜是正极,所以原电池工作时,Zn电极流出电子,发生氧化反应,B正确;C、铜是正极,溶液中的铜离子得到电子,发生还原反应,溶液颜色变浅,C不正确;D、原电池电子从负极沿导线传递到正极,所以原电池中阳离子向正极移动,则盐桥中阳离子流向CuSO4溶液中,D正确,答案选C。
考点:考查原电池的有关判断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图是用氢氧燃料电池电解氯化钠溶液(均为惰性电极),下列说法正确的是 ( )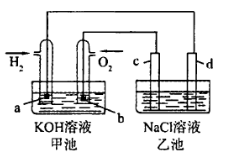
| | 甲池 | 乙池 |
| A | 放电过程中氢氧化钾浓度不变 | 滴加酚酞试液d区域溶液先变红 |
| B | 氢氧根向a极移动 | 氢氧根移向d极 |
| C | a电极消耗2.24L氢气时 | c电极生成1.12L氧气 |
| D | a电极反应:H2 -2e- =2H+ | d电极反应:4OH- -4e-=O2 + 2H2O |
某原电池总反应为:Cu+2Fe3+=Cu2++2Fe2+下列能实现该反应的原电池是
| | A | B | C | D |
| 电极材料 | Cu、Zn | Cu、Ag | Cu、C | Fe、Zn |
| 电解液 | FeCl3 | Fe2(SO4)3 | Fe(NO3)2 | CuSO4 |
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关该氢氧燃料电池的说法错误的是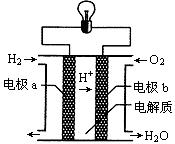
| A.该电池工作时将化学能转化为电能 |
| B.电流从电极b经外电路流向电极a |
| C.该电池中的电极b是正极 |
| D.在电极a上发生还原反应 |
下列各装置中都盛有0.1 mol·L-1的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是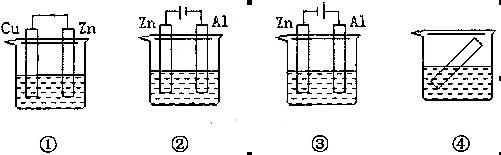
| A.③①④② | B.①②④③ | C.②①④③ | D.②①③④ |
下列现象与电化学腐蚀无关的是( )
| A.生铁比纯铁更易生锈 |
| B.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C.银质奖章久置后易表面变暗 |
| D.海轮上一般会在吃水线下绑定一定量的锌块 |
将镁条、铝条平行插入盛有一定浓度的NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )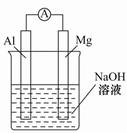
| A.Mg比Al活泼,Mg失去电子被氧化成Mg2+ |
| B.铝条表面虽有氧化膜,但可不必处理 |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
关于下列说法中正确的是( )
A.用惰性电极电解熔融氯化钠的离子方程式为:2Cl-+2H2O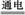 Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| B.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
C.下图为电解足量氯化钠溶液的装置,一段时间后两极收集到气体的体积之比为1∶1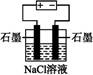 |
| D.电解精炼铜时,相同时间内阴极析出铜的质量比阳极溶解铜的质量大 |