题目内容
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如下图所示,该电池放电时,右槽中的电极反应为:V2+ - e- = V3+,下列说法正确的是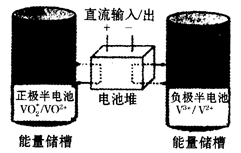
| A.放电时,右槽发生还原反应 |
| B.充电时,阴极电解液pH升高 |
| C.充电时,每转移lmol电子,n(H+)的变化量为l mol |
| D.放电时,左槽的电极反应式:VO2++ 2H+ + e-= VO2++ H2O |
D
解析试题分析:原电池中,正极发生氧化反应,负极发生还原反应,根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理和电解池的工作原理进行分析;右槽是负极,发生氧化反应,A错误;左槽是正极,发生的电极反应式:VO2++ 2H+ + e-  VO2++ H2O,D正确;负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电池反应为VO2++V2++2H+
VO2++ H2O,D正确;负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电池反应为VO2++V2++2H+ VO2++V3++H2O,所以充电时阴极电极反应为V3++e-═V2+;阳极电极反应为VO2++ H2O-e-
VO2++V3++H2O,所以充电时阴极电极反应为V3++e-═V2+;阳极电极反应为VO2++ H2O-e- VO2++ 2H+ ,充电时,阳极电解液pH降低,B错误;充电时,每转移lmol电子,n(H+)的变化量为2mol,故C错误;故选D。
VO2++ 2H+ ,充电时,阳极电解液pH降低,B错误;充电时,每转移lmol电子,n(H+)的变化量为2mol,故C错误;故选D。
考点:考查原电池的工作原理。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案热激活电池可用作火箭、导弹的工作电池。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是( )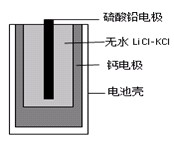
|
C.每转移0.1mol电子,理论上生成20.7gPb
D.正极反应式:Ca +2Cl--2e-=CaCl2
如图是用氢氧燃料电池电解氯化钠溶液(均为惰性电极),下列说法正确的是 ( )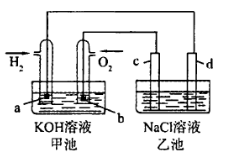
| | 甲池 | 乙池 |
| A | 放电过程中氢氧化钾浓度不变 | 滴加酚酞试液d区域溶液先变红 |
| B | 氢氧根向a极移动 | 氢氧根移向d极 |
| C | a电极消耗2.24L氢气时 | c电极生成1.12L氧气 |
| D | a电极反应:H2 -2e- =2H+ | d电极反应:4OH- -4e-=O2 + 2H2O |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2+4H++ 2e-=Pb2++2H2O | 阳极:2Al+3H2O- 6e-=Al2O3+6H+ |
| D | 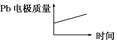 |  |
体积为1 L的某溶液中含有的离子如表所示:
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
 | 1 | 1 | a | 1 |
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是 ( )。
A.电解后溶液的pH=0
B.a=3
C.阳极生成1.5 mol Cl2
D.阴极析出的金属是铜与铝
某新型碱性可充电电池,能长时间保持稳定的放电电压。该电池的总反应为3Zn+2K2FeO4+8H2O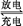 3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是( )
| A.电池放电是化学能转化成电能的过程 |
B.放电时正极反应为:Fe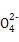 +4H2O+3e- +4H2O+3e-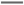 Fe(OH)3+5OH- Fe(OH)3+5OH- |
| C.充电时电池的负极接外电源的正极 |
| D.充电时电解质溶液中的阴离子向阳极定向移动 |
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )
| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式:C2H5OH+16OH--12e-=2CO+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是( )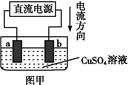
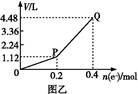
| A.电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
B.b电极上发生的反应方程式为:4OH--4e- 2H2O+O2↑ 2H2O+O2↑ |
| C.曲线0~P段表示O2的体积变化 |
| D.从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol |
将镁条、铝条平行插入盛有一定浓度的NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )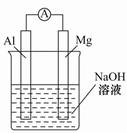
| A.Mg比Al活泼,Mg失去电子被氧化成Mg2+ |
| B.铝条表面虽有氧化膜,但可不必处理 |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |