题目内容
【题目】探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)工业上利用Na2CO3溶液吸收NO、NO2混合气制备NaNO2,该反应可实现NO和NO2的完全转化,反应的化学方程式为________。
(2)NO2可发生二聚反应生成N2O4,化学方程式为![]() ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的![]() ________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数;
________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数; ![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随![]() 变化关系的是斜线________。
变化关系的是斜线________。
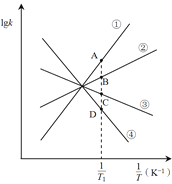
(3)图中A、B、C、D点的纵坐标分别为a + 1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=_______mol-1·L。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 mol·L-1,此时υ正________υ逆(填>或<);上述反应达到平衡后,继续通入一定量的NO2,则NO2的平衡转化率将________,NO2的平衡浓度将________(填增大、减小或不变)。
【答案】NO + NO2 + Na2CO3=2NaNO2 + CO2 < ③ ④ 10 > 增大 增大
【解析】
(1)Na2CO3溶液和NO、NO2反应生成NaNO2,再写出化学方程式;
(2)升高温度体系颜色加深,平衡逆移,则正反应为放热反应;化学反应速率和温度成正比,随着温度下降 ![]() 增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,以此分析;
增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,以此分析;
(3)化学平衡常数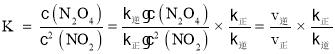 ,平衡时υ正=υ逆再利用C点和D点数据求得k逆和k正;比较浓度商Q与K值得大小,若Q>K则平衡逆移,若Q<K则平衡正移,若Q=K则达到平衡;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大。
,平衡时υ正=υ逆再利用C点和D点数据求得k逆和k正;比较浓度商Q与K值得大小,若Q>K则平衡逆移,若Q<K则平衡正移,若Q=K则达到平衡;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大。
(1)Na2CO3溶液和NO、NO2反应生成NaNO2,根据元素守恒化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)升高温度体系颜色加深,平衡逆移,则正反应为放热反应![]() <0;化学反应速率和温度成正比,随着温度下降
<0;化学反应速率和温度成正比,随着温度下降 ![]() 增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,则③表示lgk正随
增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,则③表示lgk正随![]() 变化关系的是斜线,④表示lgk逆随
变化关系的是斜线,④表示lgk逆随![]() 变化关系的是斜线,故答案为:<;③;④;
变化关系的是斜线,故答案为:<;③;④;
(3)化学平衡常数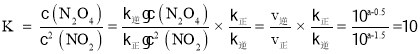 ;NO2、N2O4浓度均为0.2 mol·L-1,则浓度商
;NO2、N2O4浓度均为0.2 mol·L-1,则浓度商![]() <K,则平衡正移,υ正>υ逆;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大,故答案为:10;>;增大;增大。
<K,则平衡正移,υ正>υ逆;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大,故答案为:10;>;增大;增大。