题目内容
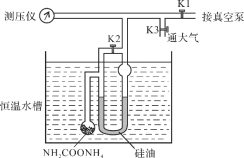
【题目】氨基甲酸铵发生分解的化学方程式为NH2COONH4(s)![]() 2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1;
(Ⅱ)关闭K2,缓慢开启K3至U型管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0 kPa、17.1 kPa。下列说法错误的是
A.氨基甲酸铵分解反应的ΔH>0
B.该反应25℃时的化学平衡常数Kp = 2.56×1011 Pa3
C.步骤Ⅰ中测压仪数值未稳定即关闭K1,Kp测量值偏小
D.步骤Ⅱ中读数时U型管左侧液面偏高,Kp测量值偏小
【答案】CD
【解析】
A. 温度升高气压增大,由反应可知,平衡正移,则正反应为吸热反应,故A正确;
B. 设CO2的压强为xPa,则NH3的压强为2xPa,总压强为12.0 kPa,则![]() ,
,![]() ,则
,则 ![]() ,故B正确;
,故B正确;
C. 步骤Ⅰ中测压仪数值未稳定即关闭K1,U型管左侧会有残留空气,导致Kp测量值偏大,故C错误;
D. 步骤Ⅱ中读数时U型管左侧液面偏高,则证明左侧气压小于右侧,Kp测量值偏大,故D错误。
故答案选CD。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目