题目内容
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 高温下,0.3molFe与足量水蒸气反应,生成的H2的体积为8.96L | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 标准状况下6.72 L NO2与水反应转移的电子数0.1NA |
分析 A.1.6g氧气和臭氧的混合物中含有1.6g氧原子,含有0.1mol氧原子;
B.高温下,Vm不知道,无法计算生成氢气的体积;
C.一个过氧化钠中含有1个过氧根离子和2个钠离子;
D.标况下6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸,转移了0.2mol电子.
解答 解:A.1.6g氧气和臭氧的混合物中含有氧原子的质量为1.6g,含有氧原子的物质的量为0.1mol,含有氧原子的数目为0.1NA,故A正确;
B.高温下,Vm不知道,无法计算生成氢气的体积,故B错误;
C.1mol Na2O2固体中含有1mol过氧根离子,2mol钠离子,共含离子总数为3NA,故C错误;
D.标况下6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸,转移了0.2mol电子,转移的电子数0.2NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的计算与判断,掌握物质的量与摩尔质量、阿伏伽德罗常数等物理量之间的关系,明确标况下气体摩尔体积的使用条件,注意过氧化钠的构成,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
14.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. | 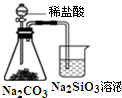 图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 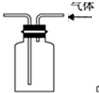 用图所示实验装置排空气法收集CO2气体 | |
| C. | 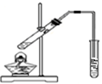 用图装置制备少量乙酸乙酯 | |
| D. | 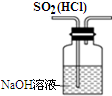 图装置可以用来除去SO2中的HCl |
11.下列有关金属的说法正确的是( )
| A. | 金属单质在常温下都是固体 | |
| B. | 金属原子只有还原性,金属阳离子只有氧化性 | |
| C. | 含金属元素的离子都是阳离子 | |
| D. | 金属阳离子被还原不一定生成金属单质 |
18.下列原子的电子排布图中,正确的是( )
| A. | 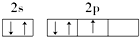 | B. | 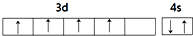 | ||
| C. | 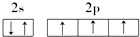 | D. | 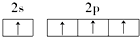 |
8.下列除杂方法正确的是( )
①除去乙烷中少量的乙烯:通过酸性高锰酸钾溶液,洗气;
②除去KNO3中少量的NaCl:溶解,蒸发浓缩,冷却结晶、过滤、干燥;
③除去CO2中少量的CO:在空气中点燃;
④除去苯中少量的苯酚:加入适量NaOH溶液,分液.
①除去乙烷中少量的乙烯:通过酸性高锰酸钾溶液,洗气;
②除去KNO3中少量的NaCl:溶解,蒸发浓缩,冷却结晶、过滤、干燥;
③除去CO2中少量的CO:在空气中点燃;
④除去苯中少量的苯酚:加入适量NaOH溶液,分液.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
15.以下化石能源的加工所得产品不符合事实的是( )
| A. | 石油分馏-乙炔 | B. | 石油裂解-乙烯 | ||
| C. | 煤焦油分馏-苯酚 | D. | 天然气热分解-炭黑 |
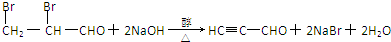 .
.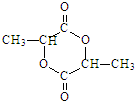 .
.