题目内容
18.下列原子的电子排布图中,正确的是( )| A. | 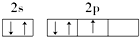 | B. | 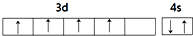 | ||
| C. | 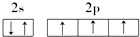 | D. | 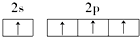 |
分析 根据构造原理确定核外电子排布式是否正确:
能量最低原理:原子核外电子先占有能量较低的轨道.然后依次进入能量较高的轨道;
泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态 相反的电子;
洪特规则:在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.
原子或离子核外电子排布属于基态排布应满足构造原理:1s、2s2p;3s3p;4s3d4p;5s4d5p;6s4f5d6p;7s5f6d7p按此顺序填充,注意满足半满、全满、全空稳定状态,
A.违反洪特规则;B.违反半满稳定状态;C.电子排布图正确;D.违反能量最低原理.
解答 解:A.在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,所以N原子的电子排布图为 ,故A错误;
,故A错误;
B.Cr为24号元素,原子核外电子数为24,其中3d能级达到半满,铬原子的电子排布图为: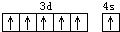 ,故B错误;
,故B错误;
C.N原子的电子排布图正确,故C正确;
D.C原子电子排布图为 ,故D错误;
,故D错误;
故选C.
点评 本题考查了原子的电子排布图的书写,掌握保里不相容原理、洪特规则、能量最低原理等理论是解本题关键,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
6.下列叙述正确的是( )
| A. | 固体时能导电的晶体一定为金属晶体 | |
| B. | 某晶体固态不导电,水溶液能导电,该晶体一定为离子晶体 | |
| C. | 某晶体难溶于水、熔点高、固态不导电,熔化时导电,可判断该晶体为离子晶体 | |
| D. | 由原子构成的晶体均具有熔沸点高、硬度大的特性 |
13.下列除去杂质的实验方法正确的是( )
| A. | 除去铜器表面的铜绿[Cu2(OH)2CO3]:用硝酸浸泡,再用清水冲洗 | |
| B. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去KNO3晶体中少量NaCl:加水溶解、蒸发浓缩、冷却结晶、过滤洗涤 | |
| D. | 除去Mg(OH)2中少量的Ca(OH)2:加水,通入CO2 |
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 高温下,0.3molFe与足量水蒸气反应,生成的H2的体积为8.96L | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 标准状况下6.72 L NO2与水反应转移的电子数0.1NA |
10.使2mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生最大程度的取代反应,则两个过程中消耗的氯气的总的物质的量是( )
| A. | 4mol | B. | 6mol | C. | 8mol | D. | 10mol |
7.电子数相同的微粒叫做等电子体,下列微粒属于等电子体的是( )
| A. | 12CO2和14CO | B. | H2O2和D2O | C. | N2和13CO | D. | NO和CO |
8.下列物质间的反应,其能量变化符合如图的是( )
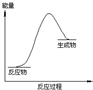

| A. | 氢气与氧气反应生成液态水 | |
| B. | 稀盐酸与金属镁反应 | |
| C. | 生石灰与稀盐酸反应 | |
| D. | 硫酸铵晶体与氢氧化钡晶体混合研磨而反应 |