题目内容
8.下列除杂方法正确的是( )①除去乙烷中少量的乙烯:通过酸性高锰酸钾溶液,洗气;
②除去KNO3中少量的NaCl:溶解,蒸发浓缩,冷却结晶、过滤、干燥;
③除去CO2中少量的CO:在空气中点燃;
④除去苯中少量的苯酚:加入适量NaOH溶液,分液.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
分析 ①乙烯被高锰酸钾氧化生成二氧化碳;
②硝酸钾和氯化钠的溶解度随温度变化不同;
③含有少量一氧化碳,不易燃烧;
④苯酚与氢氧化钠反应生成可溶的苯酚钠.
解答 解:①乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,不能除杂,应利用溴水来除杂,故错误;
②硝酸钾和氯化钠的溶解度随温度的变化不同,硝酸钾溶解度变化较大,将混合物制成热饱和溶液,冷却结晶,可得到纯净的硝酸钾,故正确;
③主要为二氧化碳,含有少量一氧化碳,不易燃烧,应通过灼热的氧化铜,故错误;
④苯酚与氢氧化钠反应生成可溶的苯酚钠,可用分液的方法分离,故正确.
故选B.
点评 本题考查混合物分离、提纯的方法及应用,为高频考点,把握物质的性质、性质差异为解答的关键,注意分离方法的选择,侧重除杂的考查,题目难度不大.

练习册系列答案
相关题目
18. 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a处溶液的pH增大,b处溶液的pH减小 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a管发生吸氧腐蚀,b管发生析氧腐蚀 | |
| D. | a、b两处具有相同的电极反应式:Fe-2e-=Fe2+ |
19.下列反应属于氮的固定的是( )
| A. | NH4Cl与Ca(OH)2反应生成NH3 | B. | 空气在雷电作用下所产生NO | ||
| C. | NO和O2生成NO2 | D. | 铜与浓硝酸反应产生NO2 |
16.下列离子方程式中正确的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 金属钠投入水中:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 氯化铁溶液与铁反应:Fe3++Fe=2 Fe2+ |
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 高温下,0.3molFe与足量水蒸气反应,生成的H2的体积为8.96L | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 标准状况下6.72 L NO2与水反应转移的电子数0.1NA |
13.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氯化钠溶液中滴入硝酸银溶液 | |
| B. | 氢气还原氧化铜 | |
| C. | 铁片置于硫酸铜溶液中 | |
| D. | 用氢氧化钠溶液溶解带氧化膜的铝片 |
17.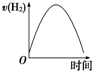 镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
 镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )| A. | 镁条的质量 | B. | 镁条的表面积 | C. | Cl-的浓度 | D. | 压强 |
18.下列推断正确的是( )
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| C. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| D. | SO2和新制氯水均有漂白性,将SO2和Cl2通入滴加少量紫色石蕊试液,充分振荡后溶液最终呈无色 |
 .
. .
.