题目内容
8.设NA为阿伏加德罗常数,下列叙述中正确的是( )| A. | l mol氯气在足量铁中反应,转移的电子数为3NA | |
| B. | 标准状况下22.4 LH2中含中子数为2 NA | |
| C. | 1 L Imol/L的氯化钠溶液中,所含氯化钠分子数为NA | |
| D. | 常温下46gNO2和N2O4混合气体中含有原子数为3NA |
分析 A、根据反应后氯元素的价态为-1价来分析;
B、氢气中无中子;
C、氯化钠是离子化合物,在溶液中完全电离,无分子存在;
D、NO2和N2O4的最简式均为NO2.
解答 解:A、反应后氯元素的价态为-1价,故1mol氯气转移2mol电子,故A错误;
B、普通氢气中氢原子为氕,无中子,故B错误;
C、氯化钠是离子化合物,是强电解质,在溶液中完全电离,无分子存在,故C错误;
D、NO2和N2O4的最简式均为NO2,故46gNO2和N2O4中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有的原子数为3NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?TCO2(g)+H2(g),有如下数据:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A. | 正反应为吸热反应 | |
| B. | 实验1中,CO的转化率为80% | |
| C. | 650℃时,化学平衡常数K=$\frac{8}{3}$ | |
| D. | 实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
16.(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5-8.6之间.某地海水中主要离子的含量如表:
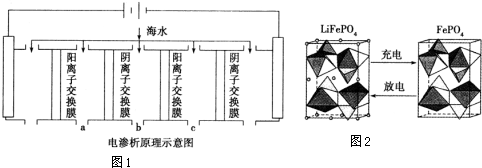
电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(2)锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(3)目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
①用K2FeO4处理中性废水时,K2FeO4与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的聚沉 作用.
②MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy 则可以判断x<y,氧化性:MFe2Oy< SO2(填“>”、“<”或“=”)
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(2)锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(3)目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
①用K2FeO4处理中性废水时,K2FeO4与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的聚沉 作用.
②MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy 则可以判断x<y,氧化性:MFe2Oy< SO2(填“>”、“<”或“=”)
3.随着社会的发展人们的生活越来越离不开化学.下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
13.加油站应张贴的标志是( )
| A. |  | B. |  | C. |  | D. |  |
20.下列家庭小实验能成功的是( )
| A. | 用淬火处理后的缝衣钢针制钓鱼钩 | B. | 用食盐水除去热水瓶中的水垢 | ||
| C. | 用电池“锌皮”与食醋反应制氢气 | D. | 用加热的方法修补电木插座 |