题目内容
18.下列化学用语正确的是( )| A. | 硫的原子结构示意图: | |
| B. | NH4Cl的电子式: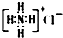 | |
| C. | 铝离子中的质子数和电子数之比为13:10 | |
| D. | 原子核内有30个中子的铁原子:2656Fe |
分析 A.硫原子的核电荷数=核外电子总算=16,最外层含有6个电子;
B.氯离子为阴离子,电子式中需要标出最外层的8个电子;
C.铝离子的质子数为13,核外电子总数为10;
D.铁原子的质子数为26,质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.硫原子质子数为16,核外电子数为16,由3个电子层,最外层电子数为6,原子结构示意图为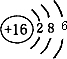 ,
, 为S2-的结构示意图,故A错误;
为S2-的结构示意图,故A错误;
B.氯化铵是离子化合物,由氨根离子与氯离子构成,其正确的电子式为 ,故B错误;
,故B错误;
C.Al3+离子中的质子数为13、电子数为10,所以其质子数和电子数之比为13:10,故C正确;
D.原子核内有30个中子的铁原子的质量数为56,该原子正确的表示方法为:2656Fe,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、原子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
9.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
| A. | 增加C的量 | |
| B. | 将容器的体积减小一半 | |
| C. | 保持体积不变,充入氮气使体系的压强增大 | |
| D. | 保持压强不变,充入氮气使体系的体积增大 |
6.A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构.下列叙述中一定不正确的是( )
| A. | 它们的原子序数A>B>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
13.相对分子质量为M的某物质在室温下溶解度为Sg,此时测得饱和溶液的密度为dg•mL-1,则该饱和溶液的物质的量浓度是( )
| A. | $\frac{M}{10Sd}$ mol•L-1 | B. | $\frac{100Sd}{M(100+S)}$ mol•L-1 | ||
| C. | $\frac{10Sd}{M}$mol•L-1 | D. | $\frac{M(100+S)}{1000Sd}$ mol•L-1 |
3.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1L 1mol/L 盐酸中含有HCl分子数为 1NA | |
| B. | 常温常压下,22.4L氧气所含的原子数为2NA | |
| C. | 实验室分别用KClO3和H2 O2制取3.2g O2时,转移的电子数均为0.4NA | |
| D. | 常温常压下,16 g 由O2和O3组成的混合气体所含电子数为8NA |
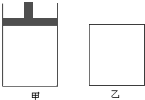 将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:
将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答: