题目内容
17. 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.请回答下列问题:(1)B电极发生反应的电极反应式4OH--4e-═2H2O+O2↑.
(2)写出电解时反应的离子方程式2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+.
(3)电解后溶液的pH为1,要使电解后溶液恢复到电解前的状态,则需加入CuO,其质量为2g.(假设电解前后溶液的体积不变)
分析 电解液是蓝色溶液,A电极表面有红色的固态物质生成,所以A极是铜离子得电子,所以A极是阴极,A接的是电源的负极,B电极有无色气体生成,则一定是氢氧根失电子产生的氧气,所以B是该装置阳极,和电源的正极相连,
(1)B为阳极,氢氧根失电子产生的氧气;
(2)电解可溶性的铜盐的实质是电解盐和水,根据电极反应书写电解方程式;
(3)根据电解后所得溶液中氢离子的浓度计算溶液的pH,电解后溶液复原,遵循的原则是:出什么加什么,根据元素守恒来计算所加物质的质量.
解答 解:电解液是蓝色溶液,A电极表面有红色的固态物质生成,所以A极是铜离子得电子,所以A极是阴极,A接的是电源的负极,B电极有无色气体生成,则一定是氢氧根失电子产生的氧气,所以B是该装置阳极,和电源的正极相连,
(1)B为阳极,氢氧根失电子产生的氧气,电极方程式为4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
(2)阴极反应:2Cu2++4e-→2Cu,阳极反应:4OH-→4e-+2H2O+O2↑,电解时反应的总离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;
(3)取出A电极,洗涤、干燥、称量、电极增重1.6g,所以阴极析出金属铜的质量是1.6g,即0.025mol,所以生成氢离子的物质的量为0.05mol,所以c(H+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,即pH=1,电解后析出了金属铜和有氧气放出,所以要想溶液复原,需加入 CuO,所加氧化铜的质量=0.025mol×80g/mol=2g,
故答案为:1;CuO;2.
点评 本题考查了电解原理,根据阴阳极上得失电子确定溶液酸碱性变化,再结合原子守恒进行计算,题目难度不大.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案 (其中n=0、1、2、3)的化合物,式中A、B是任意一种基团(或H原子),W为2价有机基团,又称为该同系列的化合物的系列差,同系列化合物的性质,往往呈现规律性变化,下列四组化合物中,不可称为同系列的是( )
(其中n=0、1、2、3)的化合物,式中A、B是任意一种基团(或H原子),W为2价有机基团,又称为该同系列的化合物的系列差,同系列化合物的性质,往往呈现规律性变化,下列四组化合物中,不可称为同系列的是( )| A. | CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 | |
| B. | CH3CHCHCHO CH3CHCHCHCHCHO CH3(CHCH)3CHO | |
| C. | CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH 2CHClCH 3 | |
| D. | ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3 |
| A. | 某物质中只含一种元素,该物质一定是纯净物 | |
| B. | H2和D2互为同位素 | |
| C. | 40K和40Ca原子中的质子数和中子数都不相等 | |
| D. | 金刚石和石墨的性质相同 |
①苯不能与溴水反应而褪色 ②苯环中碳碳键的键长键能都相等 ③邻二氯苯只有一种
④间二甲苯只有一种 ⑤在一定条件下苯与H2发生加成反应生成环已烷.
| A. | ①②③④ | B. | ①②③ | C. | ②③④⑤ | D. | ①②③⑤ |
| A. | 向FeBr2溶液中通入少量Cl2:2Br-+Cl2═2Cl-+Br2 | |
| B. | 澄清石灰水与少量的小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- |
| A. | 物质的量浓度相等的NH4Al(SO4)2、NH4HCO3、NH4Cl溶液中c(NH4+):NH4HCO3>NH4Cl>NH4Al(SO4)2 | |
| B. | 1.0mol/L Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 测得酸式盐NaHA溶液的pH=3,则NaHA在溶液中一定是电离大于水解 | |
| D. | 常温下0.4mol/L HB溶液与0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c (B-)>c (H+)>c(OH-) |
| A. | 因为盐酸的酸性强于氢硫酸,所以氯元素的非金属性强于硫 | |
| B. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl?K↑+NaCl) | |
| C. | 因为某吸热反应能自发进行,所以该反应是熵减反应 | |
| D. | 因为醋酸电离吸热,所以用NaOH溶液恰好中和等体积等浓度的醋酸和盐酸,前者放出热量少 |
| A. | Cl-的结构示意图: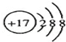 | B. | 氢氧根离子的电子式: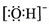 | ||
| C. | ${\;}_{6}^{12}$C的质量数为12 | D. | HClO的结构式:H-Cl-O |
 已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.