题目内容
12.下列离子方程式书写正确的是( )| A. | 向FeBr2溶液中通入少量Cl2:2Br-+Cl2═2Cl-+Br2 | |
| B. | 澄清石灰水与少量的小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- |
分析 A.氯气少量,亚铁离子的还原性大于溴离子,亚铁离子优先反应;
B.碳酸氢钠少量,离子方程式按照碳酸氢钠的化学式书写,碳酸氢根离子完全转化成碳酸钙沉淀;
C.2mol钠完全反应生成1mol氢气,该反应不满足电子守恒;
D.氨水为弱碱,二者反应生成氢氧化铝沉淀.
解答 解:A.向FeBr2溶液中通入少量Cl2,只有亚铁离子被氧化,正确的离子方程式为:2Fe2++Cl2═2Cl-+2Fe3+,故A错误;
B.澄清石灰水与少量的小苏打溶液混合,反应生成碳酸钙沉淀、氢氧化钠和水,反应的离子方程式为:Ca2++OH-+HCO3-═CaCO3↓+H2O,故B正确;
C.钠与水剧烈反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.AlCl3溶液中加入过量氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等);A为易错点,注意亚铁离子优先反应.

练习册系列答案
相关题目
2.下列元素中,原子半径最大的是( )
| A. | Na | B. | K | C. | S | D. | Cl |
3.关于下列有机反应的说法中,不正确的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl是取代反应 | |
| B. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O是氧化反应 | |
| C. | 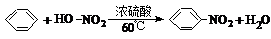 是取代反应 是取代反应 | |
| D. | 2RCH2OH+O2$→_{△}^{Cu}$2RCHO+2H2O是加成反应 |
4.今年是世界反法西斯战争暨中国人民抗日战争胜利70周年.二战期间日本是在战场上唯一大量使用毒气弹的国家.芥子气〔(ClCH2CH2)2S〕是其中一种毒气,即使嗅觉不能感受的极低浓度也会对人造成伤害,可用NaOH溶液解毒.芥子气可用以下方法制备:2CH2=CH2+S2Cl2→(ClCH2CH2)2S+S.下列有关说法正确的是
( )
( )
| A. | 芥子气不是烃的衍生物 | B. | S2Cl2中有极性键和非极性键 | ||
| C. | 制备反应中S2Cl2作还原剂 | D. | NaOH溶液解毒原理是中和反应 |
1.下列反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
2.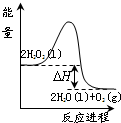 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )| A. | 该分解反应为吸热反应 | |
| B. | 2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量 | |
| C. | 加入MnO2或FeCl3均可提高该分解反应的速率 | |
| D. | 其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢 |
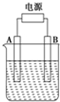 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.请回答下列问题: