题目内容
6. 在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g)所得实验数据如表:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g)所得实验数据如表:| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
(1)实验①中,若5min时测得,n(M)=0.050mo1,则0至5min时间内,用N表示的平均反应速率为1.0×10-3mol/(L•min).
(2)实验③平衡常数为1.0,该正反应为放热反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是C.
A.c(Y)=c(N) B.平均分子量不再变化
C.v正(X)=v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为60%多余.
(5)实验③、④中,达到平衡时,a与b的关系为A(填选项),请解释原因若温度不变,则b=$\frac{1}{2}$a,该反应为放热反应,温度升高,平衡向逆反应方向移动,故b<$\frac{1}{2}$a,即a>2b.
A.a>2b B.a=2b C.b<a<2b D.a<b
(6)如图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图.
分析 (1)根据平均反应速率V=$\frac{△c}{△t}$计算v(M),在利用速率之比等于化学计量数之比计算v(N);
(2)实验平衡常数仅与温度有关,则③与②的平衡常数相等,所以根据②的数据列三段式计算平衡常数;根据表格数据700℃时,化学平衡时M为0.090mol,升高温度至800℃平衡时M为0.080mol,所以升温平衡逆反应方向移动,据此判断;
(3)A.c(Y)=c(N)不能说明正逆反应速率相等;
B.因为反应前后质量和物质的量都不变,所以平均分子量一直不变化;
C.v正(X)=v逆(M)说明正逆反应速率相等;
D.因为反应前后质量和体积都不变,所以温度和压强一定时,混合气体的密度一直不变化;
(4)温度不变平衡常数不变,根据平衡常数可求出转化量,进而求出转化率;
(5)根据(1)得出正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,④与③为等效平衡,b=$\frac{1}{2}$a,但④的实际温度为900℃,相比较800℃,平衡逆向移动,b<$\frac{1}{2}$a,即a>2b;
(6)如图是实验①中c(M)随时间变化的曲线图,②中温度比①高,所以所以速率快,达平衡时间小于t1,又平衡时c(M)=0.008,比①平衡时低,据此画图.
解答 解:(1)根据反应速率之比等于系数之比,所以v(N)=v(M)=$\frac{△c}{△t}$=$\frac{0.05mol}{10L×5min}$=1.0×10-3mol/(L•min),故答案为:1.0×10-3mol/(L•min);
(2)X(g)+Y(g)?M(g)+N(g)
起始浓度(mol/L) 0.01 0.04 0 0
转化浓度(mol/L) 0.008 0.008 0.008 0.008
平衡浓度(mol/L) 0.002 0.032 0.008 0.008
实验②中,该反应的平衡常数K=$\frac{c(M)c(N)}{c(X)c(Y)}$=$\frac{0.008×0.008}{0.002×0.032}$=1.0;
根据表格数据700℃时,化学平衡时M为0.090mol,升高温度至800℃平衡时M为0.080mol,所以升温平衡逆反应方向移动,则正反应为放热反应,故答案为:1.0;放热;
(3)A.c(Y)=c(N)不能说明正逆反应速率相等,则不能判断平衡,故错误;
B.因为反应前后质量和物质的量都不变,所以平均分子量一直不变化,则不能判断平衡,故错误;
C.v正(X)=v逆(M)说明正逆反应速率相等,则能说明达到平衡,故正确;
D.因为反应前后质量和体积都不变,所以温度和压强一定时,混合气体的密度一直不变化,则不能判断平衡,故错误;
故选:C;
(4)X(g)+Y(g)?M(g)+N(g)
起始浓度(mol/L) 0.02 0.03 0 0
转化浓度(mol/L) $\frac{a}{10}$ $\frac{a}{10}$ $\frac{a}{10}$ $\frac{a}{10}$
平衡浓度(mol/L) 0.02-$\frac{a}{10}$ 0.03-$\frac{a}{10}$ $\frac{a}{10}$ $\frac{a}{10}$
该反应的平衡常数K=$\frac{c(M)c(N)}{c(X)c(Y)}$=$\frac{\frac{a}{10}×\frac{a}{10}}{(0.02-\frac{a}{10})(0.03-\frac{a}{10})}$=1.0,解得a=0.12,实验③中,X的转化率=$\frac{0.12}{0.2}$×100%=60%,故答案为:60%;
(5)根据(1)得出正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,④与③为等效平衡,b=$\frac{1}{2}$a,但④的实际温度为900℃,相比较800℃,平衡逆向移动,b<$\frac{1}{2}$a,即a>2b,故答案为:A;若温度不变,则b=$\frac{1}{2}$a,该反应为放热反应,温度升高,平衡向逆反应方向移动,故b<$\frac{1}{2}$a,即a>2b;
(6)如图是实验①中c(M)随时间变化的曲线图,②中温度比①高,所以所以速率快,达平衡时间小于t1,又平衡时c(M)=0.008,比①平衡时低,故答案为: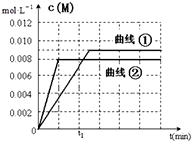
点评 本题考查化学反应速率、化学平衡常数、化学平衡的影响因素等,难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | CO2 | B. | NaOH | C. | NaHCO3 | D. | K2SO4 |
| A. | 二氧化硅为酸性氧化物,可用于制作计算机芯片 | |
| B. | 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 | |
| C. | 碳酸钠可以作为食品疏松剂 | |
| D. | 食品工业中可以用二氧化硫加工银耳,使之更白 |
| A. | Fe2O3溶于足量稀盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 实验室制CO2:CO32-+2H+=CO2+H2O | |
| C. | 向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- | |
| D. | NaHSO4溶液中加入Ba(OH)2溶液后恰好显中性Ba2++OH-+H++SO42-=BaSO4+H2O |
| A. | NaOH溶液 | B. | KSCN溶液 | C. | AgNO3溶液 | D. | BaCl2溶液 |
| A. | 根据溶液中的金属离子和残留固体的成分最多会有6种情况 | |
| B. | 若金属有剩余,在溶液中再滴入稀硫酸后,金属不会再溶解 | |
| C. | 当合金刚好溶解时,在标准状况下产生2.24LNO | |
| D. | 若合金全部溶解,在溶液中加入过量的氨水,经过滤、洗涤、干燥、充分灼烧、称量得固体5.35g |
 .
.