题目内容
【题目】现有短周期元素A、B、C、D。A元素M层上电子数是K层的3倍,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
(1)A的离子结构示意图是__________________。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:____________。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,但不能用它干燥H2S气体,其原因是___________(用化学反应的化学方程式表示)
(3)B与C元素形成带一个单位正电荷的离子,写成该微粒的电子式_________。写出实验室检验溶液中该离子的简单实验方案:___________________________。
(4)元素A与元素D相比,非金属性较强的是_________(用元素符号表示),下列表述中能表明这一事实的是_________。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)元素B、C与D组成的化合物固态时属于_______________晶体。
①原子晶体 ②离子晶体 ③分子晶体 ④分子晶体或离子晶体
【答案】 有淡黄色粉末和无色液体生成 H2S + H2SO4 === S↓+ SO2↑+2H2O
有淡黄色粉末和无色液体生成 H2S + H2SO4 === S↓+ SO2↑+2H2O 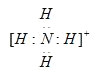 取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子。 O ②③ ④
取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子。 O ②③ ④
【解析】
A元素M层上电子数是K层的3倍,说明A为S,D与A在周期表中同一主族,则D为O,A、B与D组成的化合物的浓溶液是常见的干燥剂,该干燥剂为H2SO4,即B为H,C单质为双原子分子,其氢化物水溶液呈碱性,则C为N,据此回答问题。
(1)由分析可知A为S,B为H,C为N,D为O,那么A的离子结构示意图是![]() ; A的氢化物为H2S,其低价态氧化物为SO2,充分反应方程式为:SO2+2H2S=3S↓+2H2O,实验现象为:有淡黄色粉末和无色液体生成;
; A的氢化物为H2S,其低价态氧化物为SO2,充分反应方程式为:SO2+2H2S=3S↓+2H2O,实验现象为:有淡黄色粉末和无色液体生成;
(2)A、B与D组成的化合物的浓溶液是常见的干燥剂,该干燥剂为H2SO4,可与H2S发生氧化还原反应,反应方程式为:H2S + H2SO4 === S↓+ SO2↑+2H2O;
(3)H与N两种元素成成带一个单位正电荷的离子,为NH4+,电子式为![]() ,实验室检验NH4+的方法为:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有NH4+;
,实验室检验NH4+的方法为:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有NH4+;
(4)D与A在周期表中同一主族,同主族从上到下非金属性逐渐减弱,故非金属性较强的是O;
①由于O没有最高价氧化物对应的水化物,无法比较酸性强弱,错误;
②气态氢化物的稳定性越强,非金属性越强,正确;
③一定条件下D能从A的氢化物水溶液中置换出A单质,可知非金属性D单质强于A单质,正确;
④熔沸点的高低不能确定非金属性强弱,错误;
能表明非金属性较强的是O的事实的是②③;
(5)B、C与D组成的化合物为NH4NO3或NH3H2O,有可能是分子晶体,也有可能是离子晶体。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案