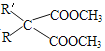
题目内容
【题目】科学家近期研发出如图所示的水溶液锂离子电池体系,下列有关叙述错误的是

A.b电极不可用石墨替代Li
B.正极反应为:Li1-xMn2O4+xLi++xe- = LiMn2O4
C.电池总反应为:Li1-xMn2O4+xLi = LiMn2O4
D.放电时,溶液中Li+从a向b迁移
【答案】D
【解析】
锂离子电池中,b为Li,失去电子,作负极,LiMn2O4为正极;充电时Li+在阴极得电子,LiMn2O4在阳极失电子,据此分析。
A. C不能失电子,故b电极不可用石墨替代Li,A项正确;
B. 正极发生还原反应,Li1-xMn2O4得电子被还原,电极反应为:Li1-xMn2O4+xLi++xe- = LiMn2O4,B项正确;
C. Li失电子,Li1-xMn2O4得电子,生成的产物为LiMn2O4,电池的总反应为:Li1-xMn2O4+xLi = LiMn2O4,C项正确;
D.放电时,阳离子移动到正极,即从b向a迁移,D项错误;
答案选D。

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目