题目内容
【题目】(1)钒是第四周期元素,工业上有广泛应用。写出钒原子的价电子排布图______________,V2O5常用作SO2转化为SO3的催化剂,S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型为_________________.
![]()
(2)光气(COCl2)是一种重要的有机中间体,其分子的立体构型为_________,其三种元素的电负性由小到大的顺序为___________________,写出与COCl2互为等电子体的分子和离子:___(各写一种)。
(3)[Co(N3)(NH3)5]SO4中Co的配位数为_________,其配离子中含有的化学键类型为__________,C、N、O中第一电离能最大的为_______,其原因是____________________。
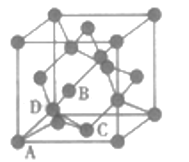
(4)如图为金刚石的晶胞,其中原子坐标参数为A(0,0,0);B(![]() ,0,
,0,![]() );C(
);C(![]() ,
,![]() ,
,![]() );则D原子的坐标参数为__________。
);则D原子的坐标参数为__________。
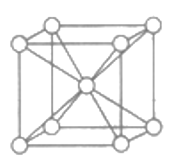
(5)晶体锌为体心立方结构,如图所示。已知锌晶体的密度为dg/cm3,NA代表阿伏加德罗常数的值。锌晶体中锌原子之间最近的核间距(D)=_______mm。
【答案】![]() sp3 平面三角形 C<Cl<O SO3(或BF3、N2Cl2等合理答案)、CO32-(或NO3-等合理答案) 6 共价键、配位键 N 氮原子2p轨道为半充满状态,较稳定,不易失去电子
sp3 平面三角形 C<Cl<O SO3(或BF3、N2Cl2等合理答案)、CO32-(或NO3-等合理答案) 6 共价键、配位键 N 氮原子2p轨道为半充满状态,较稳定,不易失去电子 ![]()
![]()
【解析】
(1)V为23号元素,其价电子排布式为3d34s2,则其价电子排布图为![]() ;S8为环状立体结构,每个S原子形成2个σ键,S上还有两对孤电子对,故S原子的杂化类型为sp3。
;S8为环状立体结构,每个S原子形成2个σ键,S上还有两对孤电子对,故S原子的杂化类型为sp3。
(2)光气的结构式为![]() ,碳原子的孤电子对数为0,价层电子对数为3,则其空间结构为平面三角形;同一周期从左到右元素的电负性逐渐增大,元素的非金属性越强电负性越大,所以C、O、Cl三种元素的电负性由小到大的顺序为C<Cl<O;原子总数相等,价电子总数也相等的微粒互为等电子体,COCl2的等电子体有SO3、BF3、N2Cl2等分子和CO
,碳原子的孤电子对数为0,价层电子对数为3,则其空间结构为平面三角形;同一周期从左到右元素的电负性逐渐增大,元素的非金属性越强电负性越大,所以C、O、Cl三种元素的电负性由小到大的顺序为C<Cl<O;原子总数相等,价电子总数也相等的微粒互为等电子体,COCl2的等电子体有SO3、BF3、N2Cl2等分子和CO![]() 、NO等离子。
、NO等离子。
(3)[Co(N3)(NH3)5]SO4中N3-、NH3都是配体,故Co的配位数是6;N3-、NH3中存在共价键,配体与中心离子间形成配位键,所以配离子中含有的化学键类型为共价键、配位键;同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但氮原子2p轨道为半充满状态,相对稳定,更不易失去电子,所以第一电离能最大的为N。
(4)由图可知,与D相连的4个原子形成正四面体,且D位于正四面体的体心。由B在x轴的坐标为![]() 知,D在x轴的坐标为
知,D在x轴的坐标为![]() ,同理得出D在y、z轴的坐标均为
,同理得出D在y、z轴的坐标均为![]() ,则D的坐标参数为
,则D的坐标参数为![]() 。
。
(5)晶胞体对角线上的锌原子相切,设锌原子半径为r,晶胞边长为a,则有![]() ,一个晶胞含有2个锌原子,则有
,一个晶胞含有2个锌原子,则有![]() ,a=
,a=![]() cm,锌原子之间最近的核间距离是
cm,锌原子之间最近的核间距离是![]() 。
。

 阅读快车系列答案
阅读快车系列答案