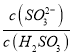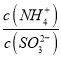题目内容
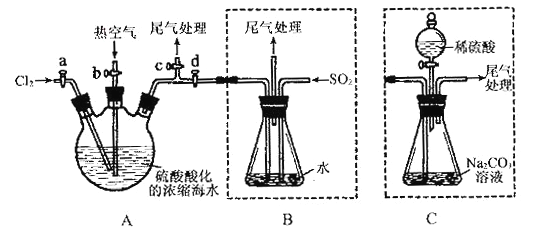
【题目】下列实验操作能达到实验目的的是
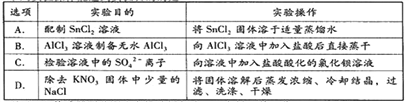
A. A B. B C. C D. D
【答案】D
【解析】A、SnCl2溶于水后要发生水解,生成Sn(OH)2 难溶物而变浑浊 SnCl2+2H2O![]() Sn(OH)2 +2HCl,加浓盐酸时,盐酸中的HCl可以抑制此反应向右进行,防止变浑浊,还要加入一定量的锡粒,加金属锡是为了将氧化变质了的Sn4+还原为Sn2+ ,使溶液保持澄清,故A错误;B、Al3++3H2O
Sn(OH)2 +2HCl,加浓盐酸时,盐酸中的HCl可以抑制此反应向右进行,防止变浑浊,还要加入一定量的锡粒,加金属锡是为了将氧化变质了的Sn4+还原为Sn2+ ,使溶液保持澄清,故A错误;B、Al3++3H2O![]() Al(OH)3+3H+ ,2Al(OH)3
Al(OH)3+3H+ ,2Al(OH)3 ![]() 2Al2O3+3H2O,直接蒸干得不到无水AlCl3,故B错误;C、加盐酸酸化的氯化钡,可能有银离子干扰,故C错误;D、先制成NaCl-KNO3的热饱和溶液,然后冷却结晶,由于KNO3溶解度随温度变化要比 NaCl溶解度随温度变化 大,所以冷却后KNO3溶解度变小,先析出,多结晶几次,就能将得到纯净的KNO3晶体,故D正确。故选D。.
2Al2O3+3H2O,直接蒸干得不到无水AlCl3,故B错误;C、加盐酸酸化的氯化钡,可能有银离子干扰,故C错误;D、先制成NaCl-KNO3的热饱和溶液,然后冷却结晶,由于KNO3溶解度随温度变化要比 NaCl溶解度随温度变化 大,所以冷却后KNO3溶解度变小,先析出,多结晶几次,就能将得到纯净的KNO3晶体,故D正确。故选D。.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目