题目内容
【题目】方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)是提炼铅及其化合物的重要矿物,其工艺流程如下:

回答下列问题:
(1)流程中“趁热”过滤的原因是_____________,滤渣的主要成分是_________________。
(2)该工艺流程中可循环利用的物质是__________________。
(3)PbSO4与PbS在加热条件下发生反应的化学方程式为_____________________。
(4)《药性论》中有关铅丹(Pb3O4)的描述是:“治惊悸狂走,呕逆,消渴。”将PbO高温焙烧可制得铅丹,铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,提纯时发生反应的离子方程是_______________。
(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,电解过程中阳极的电极反应式为____________;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池负极增重_____g。
(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中 =__________。(已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36)
=__________。(已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36)
【答案】 防止PbCl2结晶析出 Ag和Fe(OH)3 盐酸 PbS+PbSO4![]() 2Pb+2SO2 PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-) Pb2++2H2O-2e-=PbO2+4H+ 9.6 2.6×108
2Pb+2SO2 PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-) Pb2++2H2O-2e-=PbO2+4H+ 9.6 2.6×108
【解析】盐酸酸浸:PbS+2HCl=PbCl2+H2S↑,ZnS+2HCl=ZnCl2+H2S↑,Fe+2HCl=FeCl2+H2↑,通入适量Cl2:2FeCl2+Cl2=2FeCl3,调节PH=3.7,Fe3++3H2O![]() Fe(OH)3+3H+ ,加热,趁热过滤,滤渣为Ag和Fe(OH)3 ,滤液中含PbCl2和ZnCl2,冰水冷却,得PbCl2晶体,加H2SO4,H2SO4+PbCl2=PbSO4↓+2HCl,最后PbS和PbSO4混合加热,PbS+PbSO4
Fe(OH)3+3H+ ,加热,趁热过滤,滤渣为Ag和Fe(OH)3 ,滤液中含PbCl2和ZnCl2,冰水冷却,得PbCl2晶体,加H2SO4,H2SO4+PbCl2=PbSO4↓+2HCl,最后PbS和PbSO4混合加热,PbS+PbSO4![]() 2Pb+2SO2
2Pb+2SO2
(1)流程中“趁热”过滤的原因是防止PbCl2结晶析出,增加产率;滤渣的主要成分是滤渣为Ag和Fe(OH)3 ;(2)该工艺流程中,一开始盐酸是原料,H2SO4+PbCl2=PbSO4↓+2HCl,生成HCl ,可循环利用的物质是HCl;(3)PbSO4与PbS在加热条件下发生反应的化学方程式为PbS+PbSO4![]() 2Pb+2SO2;(4)铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,说明PbO具有两性,提纯时发生反应的离子方程是PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-);(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,Pb2+ 失电子被氧化,在阳极发生氧化,电解过程中阳极的电极反应式为Pb2++2H2O-2e-=PbO2+4H+ ;由电解装置中阳极Pb2++2H2O-2e-=PbO2+4H+ 增重23.9g,即生成PbO2的物质的量23.9g/239g·mol-1=0.1mol,转移电子0.2mol,蓄电池负极反应式:Pb- 2e- + SO42- PbSO4↓,增重0.1molSO42―,增重9.6g;(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中
2Pb+2SO2;(4)铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,说明PbO具有两性,提纯时发生反应的离子方程是PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-);(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,Pb2+ 失电子被氧化,在阳极发生氧化,电解过程中阳极的电极反应式为Pb2++2H2O-2e-=PbO2+4H+ ;由电解装置中阳极Pb2++2H2O-2e-=PbO2+4H+ 增重23.9g,即生成PbO2的物质的量23.9g/239g·mol-1=0.1mol,转移电子0.2mol,蓄电池负极反应式:Pb- 2e- + SO42- PbSO4↓,增重0.1molSO42―,增重9.6g;(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中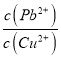 =
=![]() 。
。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案