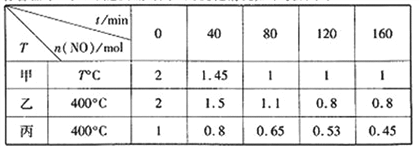
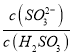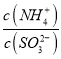题目内容
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:

(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。
【答案】 MgCO3 + 2H+ === Mg2+ + CO2↑+ H2O H2O2 + 2Fe2+ + 2H+ === 2Fe3+ + 2 H2O 3.2~9.1 NH4+ 蒸发皿、玻璃棒
【解析】由流程结合已知,菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)加稀硫酸浸取,MgCO3、FeCO3溶于稀硫酸生成Mg2+和Fe2+,加入H2O2溶液氧化Fe2+为Fe3+,然后加氨水调节pH除去Fe3+,将滤液经过结晶等一系列处理得到硫酸镁晶体(MgSO4·7H2O)。
(1)根据强酸制弱酸原理,MgCO3溶于稀硫酸生成硫酸镁、水和二氧化碳,离子方程式是MgCO3 + 2H+ = Mg2+ + CO2↑+ H2O。(2)加入H2O2溶液的目的是氧化Fe2+,离子方程式为:H2O2 + 2Fe2+ + 2H+ = 2Fe3+ + 2 H2O。(3)用氨水调节溶液pH,使Fe3+沉淀除去,不能影响Mg2+,由数据可得,pH=3.2时Fe3+沉淀完全,pH=9.1时Mg2+开始沉淀,故用氨水调节溶液pH的范围是3.2~9.1。(4)因“沉淀”步骤中使用氨水,所以“过滤”所得滤液中存在大量的阳离子有Mg2+和NH4+。(5)因为“结晶”步骤中需蒸发浓缩滤液,故使用的仪器有铁架台、酒精灯、蒸发皿和玻璃棒。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案