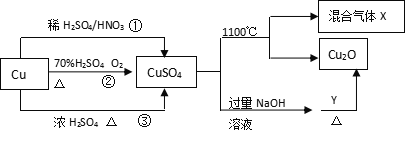
题目内容
【题目】N、Ga元素因其在生产、生活和科研领域的重要作用而备受关注。
请回答下列问题:
(1)基态Ga原子中含有___________________种能量不同的电子,其中能量最高的电子的电子云轮廓图的形状为_________________________。
(2)Ga单质有晶体和玻璃体两种形态,区别二者最可靠的科学方法为_____________________。
(3)Ga分别与N、P、AS形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
物质 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1465 | 1238 |
①从结构的角度分析,三种晶体熔点不同的原因为____________________________________。
②GaN晶体中含有的化学键类型为______________(填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.氢键
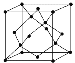
③GaP的晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。若GaP晶体的密度为pg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为____________nm。
(4)第二周期元素中,基态原子的第一电离能大于基态氮原子的有__________种。
(5)NaNH2是一种重要的工业原料。
①钠元素的焰色反应为黄色。很多金属元素能产生焰色反应的微观原因为___________________。
②NH2-中氮原子的杂化方式为_____________;该离子的空间构型为________________。
③写出与NH2-互为等电子体的分子的化学式:____________________(任写一种)。
【答案】8 哑铃形(或纺锤形) 做X-射线衍射实验 三种晶体均为原子晶体,N、P、As原子半径增大,键长增长,键能减小,熔点降低 BC ![]() 2 电子从较高能级的激发态跃迁到较低能级激发态乃至基态时,以光的形式释放能量,形成焰色反应 sp3 V形 H2O、H2S等(任写一种)
2 电子从较高能级的激发态跃迁到较低能级激发态乃至基态时,以光的形式释放能量,形成焰色反应 sp3 V形 H2O、H2S等(任写一种)
【解析】
(1)基态Ga原子的电子排布式为1s22s22p63s23p63d104s24p1,同能级电子的能量相同,故有8种能量不同的电子,其中能量最高的电子在4p能其轨道电子云轮廓图的形状为哑铃形(或纺锤形)。
(2)区分晶体和非晶体最科学的方法为X射线衍射实验。
(3)①三种品体均为原子晶体,原子晶体的熔点高低受键能影响,随着N、P、As原子半径增大,键长增长,键能减小,熔点降低②原子晶体中不含离子健和π键,氢键不属于化学键,A、D、E项错误;根据Ga原子和N原子的结构特点,GaN晶体的σ键中,部分为两种原子形成的配位键,B、C项正确。![]() 品胞中Ga和P原子的最近距离为晶胞体对角线的1/4, 设Ga和P原子的最近距离为b cm,晶参数为a cm,可得b=
品胞中Ga和P原子的最近距离为晶胞体对角线的1/4, 设Ga和P原子的最近距离为b cm,晶参数为a cm,可得b= ![]() cm,a=4
cm,a=4 ![]() b cm;每个晶胞3中含有Ga原子和P原子数目均为4个,则晶体密度
b cm;每个晶胞3中含有Ga原子和P原子数目均为4个,则晶体密度![]() g/cm-3
g/cm-3
(4)同周期元素基态原子的第一电离能从左到右有增大势,其中第ⅡA族和ⅢA族,第VA族和第AⅣ族反常,0族最大,则第二周期元素中,基态原子的第一电离能大于基态氮原子的有2种。
(5)![]() 焰色反应的本质原因是电子跃迁,NH2-中N原子的价层电子对数目为4,故氮原子的杂化方式为sp2,空间构型为V形。
焰色反应的本质原因是电子跃迁,NH2-中N原子的价层电子对数目为4,故氮原子的杂化方式为sp2,空间构型为V形。![]() 根据等电子体的含义可知,与NH2-的等电子体的分子有H2O、H2S等。
根据等电子体的含义可知,与NH2-的等电子体的分子有H2O、H2S等。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案