题目内容
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A. 检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 检验试液中的SO32-:试液![]() 气体
气体![]() 褐色
褐色
C. 检验试液中的I—:无色试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D. 检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
【答案】C
【解析】
分析亚硫酸根离子的干扰;分析亚硫酸氢根离子的干扰;碘单质遇到淀粉变蓝;亚硫酸根离子也会发生反应具有此现象。
如果溶液中含有SO32-,加入硝酸会氧化亚硫酸根离子为硫酸根离子,和氯化钡反应生成白色沉淀,A错误;如果溶液中存在HSO3-,也会产生使品红溶液褪色的二氧化硫, B错误;试液加入过氧化氢,可氧化碘离子为单质碘,遇淀粉变蓝,C正确;若原溶液中含有碳酸根离子或亚硫酸根离子,试液中加入氯化钡溶液生成白色沉淀,可能是碳酸钙或亚硫酸钙沉淀,加入盐酸沉淀溶解,D错误。
故选C。

 阅读快车系列答案
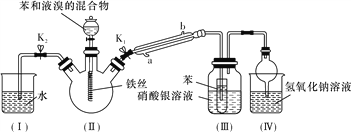
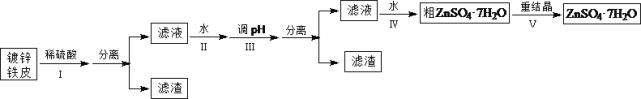
阅读快车系列答案【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。
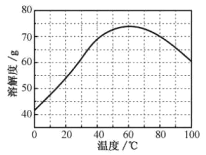
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是_______________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是_______________________________。
(3)步骤Ⅲ,合适的pH范围是_______________________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序___________________(操作可重复使用)。
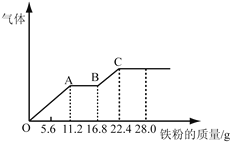
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_________方式进行冷却结晶。
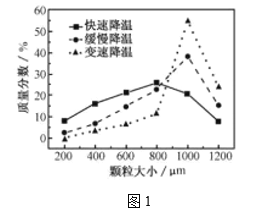
A.快速降温 B. 缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
① 下列关于滴定分析,正确的是________________。
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端

B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
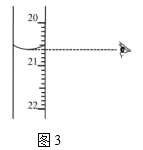
②图3中显示滴定终点时的度数是_____________mL。
【题目】N、Ga元素因其在生产、生活和科研领域的重要作用而备受关注。
请回答下列问题:
(1)基态Ga原子中含有___________________种能量不同的电子,其中能量最高的电子的电子云轮廓图的形状为_________________________。
(2)Ga单质有晶体和玻璃体两种形态,区别二者最可靠的科学方法为_____________________。
(3)Ga分别与N、P、AS形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
物质 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1465 | 1238 |
①从结构的角度分析,三种晶体熔点不同的原因为____________________________________。
②GaN晶体中含有的化学键类型为______________(填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.氢键
③GaP的晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。若GaP晶体的密度为pg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为____________nm。
(4)第二周期元素中,基态原子的第一电离能大于基态氮原子的有__________种。
(5)NaNH2是一种重要的工业原料。
①钠元素的焰色反应为黄色。很多金属元素能产生焰色反应的微观原因为___________________。
②NH2-中氮原子的杂化方式为_____________;该离子的空间构型为________________。
③写出与NH2-互为等电子体的分子的化学式:____________________(任写一种)。