题目内容
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:____与盐酸反应最剧烈;_________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____。
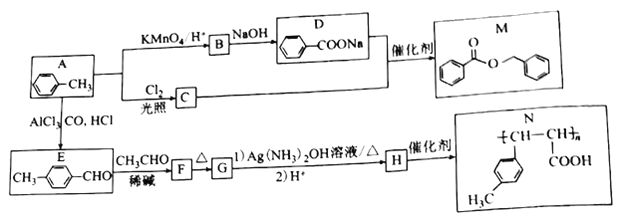
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(3)仪器B的名称为_____,干燥管D的作用为_______。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C______的现象,即可证明,从环境保护的观点考虑,此装置缺少尾气处理装置,可用_____溶液吸收尾气。
(5)若要证明非金属性:N>C>Si,则在A中加硝酸、B中加碳酸钙,并在两装置间加一个除去挥发出来的HNO3的装置,C中加_____溶液观察到C中溶液白色沉淀,即可证明。
【答案】钾 铝 S2﹣+Cl2═S↓+2Cl﹣ 锥形瓶 防止倒吸 溶液变蓝色 NaOH 硅酸钠
【解析】
根据金属性强弱分析反应剧烈程度;根据非金属性强弱分析实验原理及实验现象;根据提供的实验装置及氧化还原反应原理对非金属性强弱比较进行探究性实验。
Ⅰ.(1)反应速率由反应物的性质决定,金属性越强,与酸反应越剧烈,所以钾与盐酸反应最剧烈;相同物质的量的金属,铝失电子数最多,所以与盐酸反应生成的气体最多;
(2)Na2S与氯气反应生成硫和氯化钠,氯气为氧化剂,硫为氧化产物,所以氯气的氧化性强于硫,可证明Cl的非金属性比S强,反应的离子方程式为S2﹣+Cl2═S↓+2Cl﹣;
Ⅱ.(3)如图所示仪器B的名称为锥形瓶;根据图示,干燥管中没有干燥剂,而一端插入溶液,所以干燥管D的作用为防止倒吸;
(4)B中生成的氯气可以置换出碘化钾中的碘,淀粉遇碘变蓝,所以观察到C中的现象为溶液变蓝色;过量的氯气有毒,所以应该用NaOH进行尾气处理;
(5)若要证明非金属性:N>C>Si,则需证明它们最高价氧化物的水化物酸性:硝酸>碳酸>硅酸,利用强酸制弱酸的原理加以证明,B装置中产生二氧化碳气体,说明硝酸的酸性强于碳酸,将除去硝酸蒸气后的二氧化碳气体通入C中的硅酸钠溶液,生成难溶的硅酸,则说明碳酸酸性强于硅酸,故答案为: 硅酸钠。

【题目】N、Ga元素因其在生产、生活和科研领域的重要作用而备受关注。
请回答下列问题:
(1)基态Ga原子中含有___________________种能量不同的电子,其中能量最高的电子的电子云轮廓图的形状为_________________________。
(2)Ga单质有晶体和玻璃体两种形态,区别二者最可靠的科学方法为_____________________。
(3)Ga分别与N、P、AS形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
物质 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1465 | 1238 |
①从结构的角度分析,三种晶体熔点不同的原因为____________________________________。
②GaN晶体中含有的化学键类型为______________(填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.氢键
③GaP的晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。若GaP晶体的密度为pg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为____________nm。
(4)第二周期元素中,基态原子的第一电离能大于基态氮原子的有__________种。
(5)NaNH2是一种重要的工业原料。
①钠元素的焰色反应为黄色。很多金属元素能产生焰色反应的微观原因为___________________。
②NH2-中氮原子的杂化方式为_____________;该离子的空间构型为________________。
③写出与NH2-互为等电子体的分子的化学式:____________________(任写一种)。