题目内容
(8分)
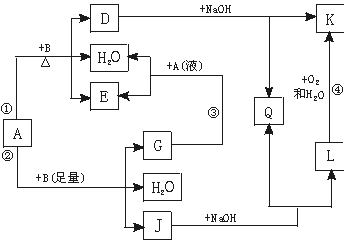
某些化学反应可用下式表示A+B→→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A、C均含有铝元素。①当B是盐酸时,C是 ;
②当B是NaOH时,C是 。
(1)Cl2+2OH-=Cl-+ClO-+H2O ; (2)C、浓H2SO4; (3)AlCl3、NaAlO2
解析试题分析:(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,则满足该反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O ; 若C、D均为气体且都能使澄清石灰水变浑浊,则发生的反应为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O ,A与B的组合是C、浓H2SO4; (3)若A、C均含有铝元素。①当B是盐酸时,则发生反应:NaAlO2+4HCl=NaCl+AlCl3+2H2O。则C是AlCl3。②当B是NaOH时,发生反应: AlCl3+4NaOH= NaAlO2+ NaCl+2H2O。C是NaAlO2.
CO2↑+2SO2↑+2H2O ,A与B的组合是C、浓H2SO4; (3)若A、C均含有铝元素。①当B是盐酸时,则发生反应:NaAlO2+4HCl=NaCl+AlCl3+2H2O。则C是AlCl3。②当B是NaOH时,发生反应: AlCl3+4NaOH= NaAlO2+ NaCl+2H2O。C是NaAlO2.
考点:考查元素及化合物的推断及相互转化的关系的知识。

下列有关金属元素及其化合物说法不正确的是
| A.铁和氯气反应生成三价铁,和盐酸反应生成亚铁离子 |
| B.铜在潮湿的空气中易生锈呈绿色,锈的主要成分是碱式碳酸铜 |
| C.过氧化钠和氧化钠均可以与水、二氧化碳反应,但生成的产物不完全相同 |
| D.等质量的铝分别与足量的酸和碱溶液反应,生成气体的体积一定相同 |
(12分)某小组进行铝热反应实验,装置如图所示。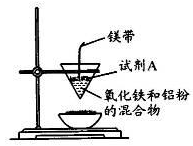
(1)铝热反应原理____(写化学方程式);试剂A为____(写化学式).实验现象____、有黑色固体生成。
(2)对黑色固体物质的组成,小组进行了如下探究
假设I该黑色物质为铁
假设Ⅱ该黑色物质为铁与四氧化三铁的混合物
【设计方案并实验】
| 实 验 步 骤 | 现 象 | 结 论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
你认为上述结论是否合理,__ __理由是__ __。
(3)取上述实验所得溶液,滴人适量氯水溶液变红色。此时涉及的离子反应方程式为
__ __、__ __;
利用反应体系中存在的平衡,小组再将溶液均分置于两支试管中并分别编号l、2.进行
如下探究:
| 实验编号 | 实验步骤 |
| 1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| | ①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
主要探究的问题是__ __;
应重点观察的现象是__ __
预计得出的结论是__ __。
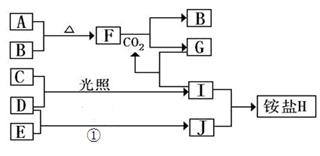
(12分)某研究性学习小组在网上搜集到信息:钾、钙、钠、镁等活泼金属能在CO2气体中燃烧。他们对钠在CO2气体中燃烧进行了下列实验:
| 操作过程 | 实验现象 |
| 将干燥的玻璃燃烧匙中燃烧的钠迅速 伸入到盛有装满CO2的集气瓶中 | 钠在盛有CO2的集气瓶中继续燃烧 |
| 反应后冷却 | 集气瓶底附着黑色颗粒,瓶壁上附着有白色 物质 |
a.水 b.泡沫灭火剂 c.干沙土 d.二氧化碳
(2)该小组同学对瓶壁上的白色物质的成分进行讨论并提出假设
I.白色物质是Na2O;
II.白色物质是Na2CO3;
III.白色物质还可能是
(3)
| 实验步骤 | 实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全 部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
②写出该反应的方程式 。
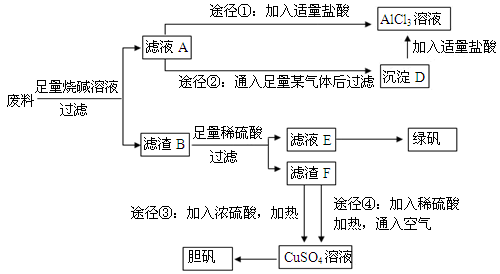
 和
和 外,还可能存在 (用元素符号表示)。
外,还可能存在 (用元素符号表示)。