题目内容
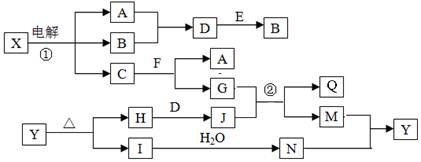
(10分)如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要的固氮反应。
(1)单质E的结构式_____________
(2)F和H2O反应的化学方程式为_____________________________,该反应中被氧化与被还原的物质的物质的量之比是_________________
(3)铵盐H中阳离子的电子式_______________,检验H 中阳离子的方法是____________________
_____________________________________________________________________________
(1)N≡N
(2)2Na2O2+2H2O=4NaOH+O2↑ ; 1:1
(3) 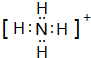 ;取少量H样品放入试管中,加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+
;取少量H样品放入试管中,加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+
解析试题分析:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐H为NH4Cl,故C为Cl2;
(1)单质E为N2,分子中N原子之间形成3对共用电子对,其结构式为N≡N;
(2)F为过氧化钠,与H2O反应生成氢氧化钠与氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应中被氧化与被还原的物质都是过氧化钠,由电子转移守恒可知,被氧化与被还原过氧化钠的物质的量之比是1:1;
(3)铵盐H为NH4Cl,NH4+离子的电子式为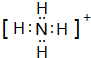 ,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
考点:考查无机物推断、电子式、结构式书写、离子检验等相关知识。

 名校课堂系列答案
名校课堂系列答案4.6g钠投入100g水中,下列叙述错误的是
| A.钠浮在水面,熔化成银色光亮的小球 | B.钠贮存在煤油中 |
| C.所得溶液的质量分数为4.4﹪ | D.该反应中转移0.2mole- |
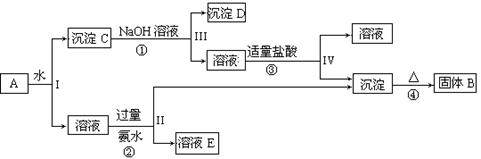
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):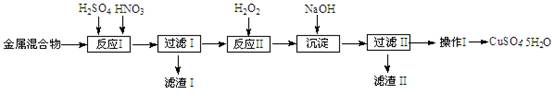
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
(2)反应Ⅱ中加入H2O2的作用是______。
(3)沉淀过程中发生反应的离子方程式有______、______。
(4)操作Ⅰ的步骤是______、______、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
a. 准确称取3.125g胆矾晶体样品配成100mL溶液;
b. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:
2Cu2+ +4Iˉ=2CuI↓ + I2
c. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O
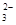 = 2Iˉ+S4O
= 2Iˉ+S4O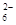
求样品中胆矾晶体的质量分数(写出计算过程)。
(10分)下图是研究铜与浓硫酸的反应装置: 
(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
A.铜与浓硫酸反应时所涉及的反应可能不止一个 B.硫酸浓度选择适当,可避免最后产物中出现黑色物质;C.该反应发生的条件之一是硫酸浓度≥15 mol·L D.硫酸浓度越大,黑色物质越快出现、越难消失