题目内容
(12分)某小组进行铝热反应实验,装置如图所示。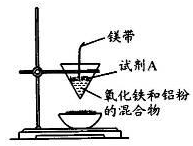
(1)铝热反应原理____(写化学方程式);试剂A为____(写化学式).实验现象____、有黑色固体生成。
(2)对黑色固体物质的组成,小组进行了如下探究
假设I该黑色物质为铁
假设Ⅱ该黑色物质为铁与四氧化三铁的混合物
【设计方案并实验】
| 实 验 步 骤 | 现 象 | 结 论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
你认为上述结论是否合理,__ __理由是__ __。
(3)取上述实验所得溶液,滴人适量氯水溶液变红色。此时涉及的离子反应方程式为
__ __、__ __;
利用反应体系中存在的平衡,小组再将溶液均分置于两支试管中并分别编号l、2.进行
如下探究:
| 实验编号 | 实验步骤 |
| 1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| | ①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
主要探究的问题是__ __;
应重点观察的现象是__ __
预计得出的结论是__ __。
(1)Fe2O3+2Al Al 2O3+2 Fe KClO3(或Na2O2) 火星四射 有强光(或放出大量的热)
Al 2O3+2 Fe KClO3(或Na2O2) 火星四射 有强光(或放出大量的热)
(2)不合理 Fe3O4与酸反应生成的Fe3+与Fe反应生成Fe2+,滴入KSCN溶液后也不变色
(3)2 Fe2++Cl2="2" Fe3++2Cl- Fe3++3SCN- Fe(3SCN)3
Fe(3SCN)3
浓度对化学平衡的影响
溶液颜色的变化
增大反应物的浓度,平衡向正反应方向移动;减小反应物浓度,平衡向逆反应方向移动
解析试题分析:(1)铝热反应的原理是铝与金属氧化物反应制取其他金属单质,所以铝与氧化铁的化学方程式为Fe2O3+2Al Al 2O3+2 Fe;试剂A为镁的燃烧提供氧化剂,所以试剂A是KClO3(或Na2O2),实验现象是镁燃烧时火星四射、有强光(或放出大量的热);
Al 2O3+2 Fe;试剂A为镁的燃烧提供氧化剂,所以试剂A是KClO3(或Na2O2),实验现象是镁燃烧时火星四射、有强光(或放出大量的热);
(2)该实验方案不合理,因为若为假设II,则在步骤①中若Fe过量,四氧化三铁与盐酸反应生成的铁离子与Fe反应也生成Fe2+,滴入KSCN溶液后也不变色,所以不合理;
(3)氯水中的氯气可以氧化亚铁离子为铁离子,铁离子与SCN-反应溶液变红色,离子方程式为2 Fe2++Cl2="2" Fe3++2Cl-;Fe3++3SCN- Fe(3SCN)3
Fe(3SCN)3
铁离子与SCN-存在平衡Fe3++3SCN- Fe(3SCN)3,根据实验步骤判断,滴加饱和氯化铁溶液目的是增大反应物的浓度,滴加氢氧化钠溶液,目的是降低铁离子的浓度,观察溶液颜色的变化,从而判断平衡移动的方向,所以该实验主要探究的问题是浓度对化学平衡的影响;应重点观察的现象是溶液颜色的变化;预计得出的结论是增大反应物的浓度,平衡向正反应方向移动;减小反应物浓度,平衡向逆反应方向移动。
Fe(3SCN)3,根据实验步骤判断,滴加饱和氯化铁溶液目的是增大反应物的浓度,滴加氢氧化钠溶液,目的是降低铁离子的浓度,观察溶液颜色的变化,从而判断平衡移动的方向,所以该实验主要探究的问题是浓度对化学平衡的影响;应重点观察的现象是溶液颜色的变化;预计得出的结论是增大反应物的浓度,平衡向正反应方向移动;减小反应物浓度,平衡向逆反应方向移动。
考点:考查对实验方案的评价,铝热反应,浓度对化学平衡的影响

下列关于钠的化合物的叙述中正确的是( )
| A.Na2O和Na2O2都是白色固体 |
| B.Na2CO3能与石灰水反应而NaHCO3不反应 |
| C.Na2CO3受热后稳定性比NaHCO3强 |
| D.Na2O和Na2O2都能与水反应生成O2 |
将2.72g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得反应后放出标准状况下气体0.224 L.则下列判断中正确的是
| A.原混合物中n(Fe)∶n(Fe2O3)=3∶1 |
| B.反应后溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
| C.实际参加反应HCl的物质的量为0.08mol |
| D.向溶液中滴入KSCN溶液,显红色 |
某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是
| A.钠着火剧烈燃烧产生苍白色的火焰 |
| B.反应产生的大量白烟是氯化钠固体 |
| C.棉球①的作用是吸收过量氯气防止产生污染 |
| D.棉球②变蓝色则证明氯气未被碱液完全吸收 |
有a、b、c、d、e五种金属。已知:a、c均能与稀硫酸反应放出气体;b能与d的硝酸盐反应,置换出d单质;c与强碱溶液反应放出气体;c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次是( )
| A.Al、Cu、Ag、Mg、Fe | B.Fe、Cu、Al、Ag、Mg |
| C.Mg、Cu、Al、Ag、Fe | D.Mg、Ag、Al、Cu、Fe |
不同金属离子在溶液中完全沉淀时,溶液的pH不同。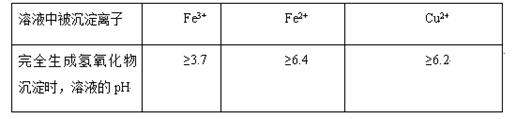
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
(1)下列氧化剂中适合作氧化剂X的是 (填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.Cl2 |
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式: 。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。