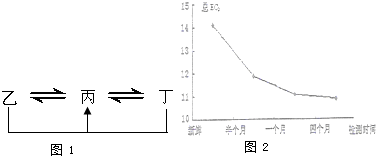
��Ŀ����
��14�֣�A��B��C��D��E��F�����ֶ���������Ԫ�أ����ǵ�ԭ������������������C��F�ֱ���ͬһ����Ԫ�أ�A��F����Ԫ�ص�ԭ�Ӻ���������֮�ͱ�C��D����Ԫ��ԭ�Ӻ���������֮����2��FԪ�ص������������Ǵ�����������0.75������֪BԪ�ص��������������ڲ��������2����EԪ�ص�������������������Ӳ�������ش�
��1��1 mol��E��F����Ԫ����ɵĻ��������A��C��D����Ԫ����ɵĻ����ﷴӦ���������κ�ˮ����ȫ��Ӧ�����ĺ��ߵ����ʵ���Ϊ ��
��2��A��C��F������γɼס������ָ�һ��˫ԭ�������ӣ�����18�����ӣ�����10�����ӣ�������ҷ�Ӧ�����ӷ���ʽΪ ��
��3����ѧ�о�֤������ѧ��Ӧ��ֻ��ʼ��̬�йأ�������ء�����B��ȼ����Ϊa kJ/mol����B��C����Ԫ����ɵĻ�����BC 14g��ȫȼ�շų�����b kJ��д������B�͵���C��Ӧ����BC���Ȼ�ѧ����ʽ�� ��
��4����ҵ���ڸ��µ������£�������A2C��BC��Ӧ��ȡ����A2���ڵ������I��II�����ܱ������зֱ����1 molA2C��1mol BC��2 mol A2C��2 mol BC��һ�������£���ַ�Ӧ��ֱ�ﵽƽ�⣨�������¶���ȣ�������˵����ȷ���ǡ�
A���ﵽƽ������Ҫ��ʱ�䣺I>II B���ﵽƽ���A2C��ת���ʣ�I=II
C���ﵽƽ���BC�����ʵ�����I>II D���ﵽƽ���A2�����������I<II
��5����BԪ�صĵ�����EԪ�صĵ��ʿ����Ƴɵ缫������A��C��D����Ԫ����ɻ��������Һ�й��ɵ�أ����ظ�����ӦʽΪ ��
��1��8 mol��3�֣�
(2) HS-+OH-=S2-+H2O��2�֣�
(3) C(s)+ 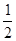 O2(g)=CO(g)����H= -(a-2b) kJ/mol��3�֣�
O2(g)=CO(g)����H= -(a-2b) kJ/mol��3�֣�
(4)A��B ��4�֣���5��2Al+8OH- -6e-=2AlO2-+4H2O��2�֣�
��������BԪ�ص��������������ڲ��������2����ֻ��CԪ�أ���B��C��FԪ�ص������������Ǵ�����������0.75�������ڶ�����Ԫ���д���������һ����2��8������FԪ�ص�������������6����ΪSԪ�ء�C��F�ֱ���ͬһ����Ԫ�أ���C��OԪ�ء�
EԪ�ص�������������������Ӳ���������E��ԭ��������ӦO�ģ�����E�ǵ�������Ԫ�أ���Ϊ��Ԫ�ء�A��F����Ԫ�ص�ԭ�Ӻ���������֮�ͱ�C��D����Ԫ��ԭ�Ӻ���������֮����2������A��F����Ԫ�ص�ԭ�Ӻ���������֮��������17������Dһ��λ�ڵ������ڣ���D������NaҲ������Mg����D���ƣ���A����Ԫ�ء���D��þ����A��He�����������⡣
��1��E��F����Ԫ����ɵĻ��������A��C��D����Ԫ����ɵĻ����ﷴӦ�ķ���ʽΪAl2S3��8NaOH=2NaAlO2��3Na2S��4H2O��
��2��A��C��F������γɼס������ָ�һ��˫ԭ�������ӣ����м���18�����ӣ�����10�����ӣ����Էֱ�ΪHS����OH��������ʽΪ HS-+OH-=S2-+H2O��
��3�������˹���ɵ�Ӧ�á�������֪��C(s)��O2(g)��CO2(g) ��H����a kJ/mol����CO(g)+1/2O2(g)��CO2(g) ��H����2b kJ/mol��
�٣��ڵ�C(s)+
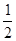 O2(g)=CO(g)����H= -(a-2b) kJ/mol
O2(g)=CO(g)����H= -(a-2b) kJ/mol
��4��A2C��BC��Ӧ��ȡ����A2�ķ���ʽΪCO��H2O(g) CO2��H2����Ϊ��Ӧǰ��������䣬�����������еĻ�ѧƽ���ǵ�Ч�ģ��������ʵĺ�����ͬ�������ʵ�Ũ�Ȳ�ͬ�����к��ߵ�Ũ�Ⱦ���ǰ�ߵ�2�����ڢ�������ѹǿ��Ӧ�쵽��ƽ���ʱ��̡�
CO2��H2����Ϊ��Ӧǰ��������䣬�����������еĻ�ѧƽ���ǵ�Ч�ģ��������ʵĺ�����ͬ�������ʵ�Ũ�Ȳ�ͬ�����к��ߵ�Ũ�Ⱦ���ǰ�ߵ�2�����ڢ�������ѹǿ��Ӧ�쵽��ƽ���ʱ��̡�
��5��̼�缫�����缫�������Ӻ��������������Һ�У����Ǹ������缫��ӦʽΪ2Al+8OH- -6e-=2AlO2-+4H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�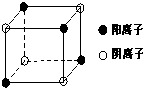 [��ѧ/ѡ��/���ʽṹ������]A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������Ԫ�ض�Ӧ�ĵ��ʾ�Ϊ���壮A��C��E��Ԫ�ص�ԭ�Ӻ����ֻ��2��δ�ɶԵ��ӣ�B��EԪ�ص�ԭ������֮�͵���C��DԪ�ص�ԭ������֮�ͣ�
[��ѧ/ѡ��/���ʽṹ������]A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������Ԫ�ض�Ӧ�ĵ��ʾ�Ϊ���壮A��C��E��Ԫ�ص�ԭ�Ӻ����ֻ��2��δ�ɶԵ��ӣ�B��EԪ�ص�ԭ������֮�͵���C��DԪ�ص�ԭ������֮�ͣ�