题目内容
【题目】A、B、C、D、E是原子序数依次增大的前四周期的常见元素。己知:
A | 原子半径最小 |
B | 核外3个能级上的电子数相等 |
C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
D | 2p轨道上成对电子数与未成对电子数相等 |
E | N 层电子数为1,内层轨道全部排满电子 |
(1)写出E原子基态核外电子排布式_____________。比较B、C、D电负性的大小顺序______ (按由小到大) 。
(2)与C2互为等电子体的分子有_______,离子有_________。
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图),画出其中E2+离子与N、O原子间的化学键。________。

(4)E和金(Au)形成的合金的晶胞结构如图,则该合金的化学式可表示为________________。

【答案】 1s22s22p63s23p63dl04s1 或[Ar] 3d104s1 C N O CO CN-或C22- 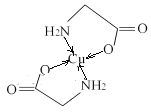 Cu3Au
Cu3Au
【解析】试题分析:由题意知,A原子半径最小,则A为H;B核外3个能级上的电子数相等,其电子排布式为1s22s22p2,则B为C;D的2p轨道上成对电子数与未成对电子数相等,其电子排布式为1s22s22p4,则D为O;C的氢化物的沸点比同族相邻周期元素氢化物的沸点高,则C为N,其氢化物可以形成分子间氢键,故沸点较高;E的N层电子数为1,内层轨道全部排满电子,则其价电子排布式为3d104s1,E为Cu。所以A、B、C、D、E分别为H、C、N、O、Cu等元素。
(1)Cu原子基态核外电子排布式为1s22s22p63s23p63dl04s1或[Ar]3d104s1。比较C、N、O电负性由小到大的顺序为C N O 。
(2)与N2互为等电子体的分子有CO,离子有CN-或C22-。
(3)Cu2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物,其中Cu2+离子与N、O原子间的化学键可表示为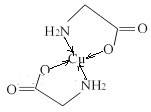 。
。
(4)由Cu和金(Au)形成的合金的晶胞结构示意图可知,该晶胞中有1个Au原子(8个顶点,8![]() )、3个Cu原子(6个面心,6
)、3个Cu原子(6个面心,6![]() ),则该合金的化学式可表示为Cu3Au.
),则该合金的化学式可表示为Cu3Au.