题目内容
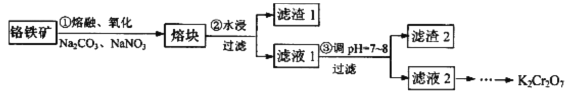
【题目】重铬酸钾是一种重要的化工原料,某科研小组采用如下方案由铬铁矿(主要成分为FeO·Cr2O3,还含有SiO2、Al2O3 等杂质)制备重铬酸钾。
己知:①铬铁矿在熔融、氧化过程中发生的主要反应:
FeO·Cr2O3+Na2CO3+ NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CO3+Al2O3![]() NaA1O2+CO2↑
NaA1O2+CO2↑
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③有关物质的溶解度如图所示。

(1)步骤①中反应物NaNO3的作用是_______,熔融时所用的仪器为________(填字母)。
A瓷坩埚 B.铁坩埚 C.氧化铝坩埚
(2)步骤②所得的滤渣1中含量最多的金属元素是___________。
(3)步骤③可用醋酸调节滤液1的pH至7~8,可用__________(填仪器或用品名称)测定溶液的pH,写出步骤③加醋酸生成Al(OH)3 的离子方程式____________________________________。
(4)请设计从滤液2(主要溶质为Na2CrO4)制取K2Cr2O7固体的实验方案:__________(实验中须使用的试剂有: KC1固体、1mol/L硫酸溶液)。
【答案】 作氧化剂 B 铁 pH计(或pH试纸) CH3COOH+A1O2- +H2O =A1(OH)3 ↓+CH3COO- 向滤液2中加入足量的1mol/L硫酸溶液,充分反应后,再加适量KCl 固体,蒸发浓缩、冷却(至0℃~20℃均可),结晶,过滤,(冷水)洗涤,干燥
【解析】试题分析:由流程及题中信息可知,铬铁矿在熔融、氧化后,铬和铁的化合价分别升高到+6和+3;熔块经水浸后,铬酸钠、亚硝酸钠、偏铝酸钠、硅酸钠等可溶性盐被水浸出,过滤后,得到滤渣主要为氧化铁。将滤液调pH,偏铝酸钠、硅酸钠等转化为沉淀,过滤除去沉淀,滤液经酸化、分离提纯得到重铬酸钾。
(1)步骤①中反应物NaNO3的作用是作氧化剂,熔融时为防止坩埚被纯碱等物质腐蚀,所用的仪器为铁坩埚,选B。
(2)步骤②所得的滤渣1主要为氧化铁,所以其中含量最多的金属元素是铁。
(3)步骤③可用醋酸调节滤液1的pH至7~8,可用pH计(或pH试纸)测定溶液的pH。步骤③加醋酸生成Al(OH)3 的离子方程式为CH3COOH+A1O2- +H2O =A1(OH)3 ↓+CH3COO-。
(4)从滤液2(主要溶质为Na2CrO4)制取K2Cr2O7固体,由信息②可知,先将滤液酸化,然后根据信息③中溶解度的数据,再向滤液中加入KCl,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。经优化后,具体的实验方案为:向滤液2中加入足量的1mol/L硫酸溶液,充分反应后,再加适量KCl 固体,蒸发浓缩、冷却(至0℃~20℃均可),结晶,过滤,(冷水)洗涤,干燥。

【题目】某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要____________________。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
II.固定好滴定管并使滴定管尖嘴充满液体,调节液而至“0”或“0”刻度线以下,并记录读数
III.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
VI.用标准液滴定至终点,记录滴定管液血读数。
①上述滴定步骤中有错误的是(填编号)_________,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
②步骤IV中滴定时眼睛应________;判断滴定终点的现象是________。
③若步骤II中仰视读数,步骤IV中俯视读数,则会使测定结果____(填“偏大”、“偏小”或“无影响”)。
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=______;②烧碱样品的纯度为________%。

【题目】A、B、C、D、E是原子序数依次增大的前四周期的常见元素。己知:
A | 原子半径最小 |
B | 核外3个能级上的电子数相等 |
C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
D | 2p轨道上成对电子数与未成对电子数相等 |
E | N 层电子数为1,内层轨道全部排满电子 |
(1)写出E原子基态核外电子排布式_____________。比较B、C、D电负性的大小顺序______ (按由小到大) 。
(2)与C2互为等电子体的分子有_______,离子有_________。
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图),画出其中E2+离子与N、O原子间的化学键。________。

(4)E和金(Au)形成的合金的晶胞结构如图,则该合金的化学式可表示为________________。




