题目内容
15.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1mol HCl(g)放出Q1热量 | |
| D. | 等物质的量时,Br2(g)具有的能量低于Br2(l) |
分析 两个反应都是放热反应,生成物的总能量低于反应物的总能量;由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1;物质在气态时具有的能量一般高于液态和固态时,以此解答该题.
解答 解:A.氯气更活泼,所以反应物总能量高,氯化氢更稳定,所以生成物总能量低,即相对大小差值大,所以放出能量多,应为Q1>Q2,故A正确;
B.两个反应都是放热反应,生成物的总能量低于反应物的总能量,故B错误;
C.由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1,故C错误;
D.物质在气态时具有的能量一般高于液态和固态时,则1molBr2(g)具有的能量高于1molBr2(l)具有的能量,故D错误;
故选A.
点评 本题考查化学能与热能的转化,题目难度不大,易错点为A,注意比较反应热的角度,可从键能的角度比较.

练习册系列答案
相关题目
3.X、Y、Z、W、M均为短周期元素,X,Y同主族,X的氯化物和其最高氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第三周期连续的三种元素,其中只有一种是非金属元素,且原子半径Z>W>M.下列叙述正确的是( )
| A. | X、M两元素最简单氢化物的稳定性:X<M | |
| B. | Z、W、M的单质均能与稀硫酸反应制取氧气,且反应剧烈程度依次减弱 | |
| C. | Y的最高价含氧酸的化学式为H2YO2 | |
| D. | W和M的氧化物均可作耐高温材料 |
10.分子式为C4H8O2,且含有-COO-结构的同分异构体有几种( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
20.与下列事实对应的化学用语错误是( )
| A. | 纯碱溶液能清洗油污:CO32-+H2O?HCO3-+OH- | |
| B. | 配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+ | |
| C. | 含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH-+CO32-+3H+→HCO3-+2H2O | |
| D. | NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O |
4.金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
(3)求该混合物中Be2C与CaC2的物质的量之比.
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 6.2 | 9.3 | 15.5 | 21.7 |
| 水(mL) | 18 | 18 | 18 | 18 |
| 气体(L,标准状况) | 3.36 | 5.04 | 8.4左右 | 8.4左右 |
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
 ,该氢化物中含有的化学键是极性共价键.
,该氢化物中含有的化学键是极性共价键.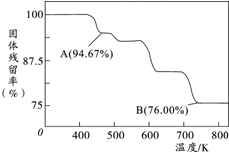 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.
 B.
B. C.
C. D.
D.