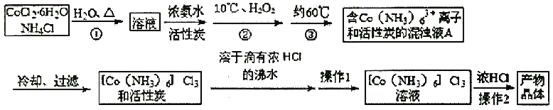
题目内容
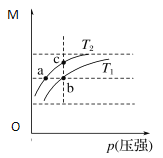
【题目】四种晶体的晶胞结构如图所示,下列有关说法正确的是( )
A.图甲所示晶体的化学式为A3B4C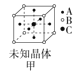
B.图乙所示晶体中阴阳离子个数比为1:1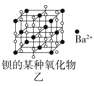
C.图丙所示CaF2晶体中Ca2+配位数为4,F-配位数为8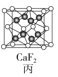
D.图丁所示晶体属于简单立方堆积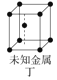
【答案】B
【解析】
A. 由图甲可知,A原子位于6个面心,6![]() 3;B位于8个顶点上,8
3;B位于8个顶点上,8![]() 1;C位于体心,只有1个。因此,所示晶体的化学式为A3BC,A不正确;
1;C位于体心,只有1个。因此,所示晶体的化学式为A3BC,A不正确;
B. 由图乙可知,每个Ba2+离子周围有6个![]() ,而每个
,而每个![]() 周围有6个Ba2+,因此,所示晶体中阴阳离子个数比为1:1,B正确;
周围有6个Ba2+,因此,所示晶体中阴阳离子个数比为1:1,B正确;
C. 由图丙可知,位于顶点和面心的是Ca2+,共有4个;位于体内的是F-,共有8个。位于相邻的4个所形成的正四面体的体心,因此,所示CaF2晶体中F-配位数为4,则Ca2+配位数为8, C不正确;
D. 图丁不能表示简单立方堆积,简单立方堆积的晶胞的体内没有原子,D不正确。
综上所述,有关说法正确的是B,故选B。

练习册系列答案
相关题目