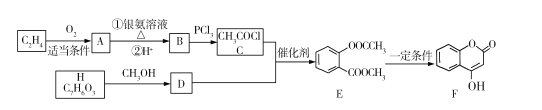
题目内容
【题目】某三元羧酸 H3A 在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向 10 mL 0.01 mol·L1 的 H3A 溶液中滴入 0.01 mol·L1 的 NaOH 溶液,H3A、H2A、HA2、A3的物质的量分数与溶液的 pH 的关系如 图所示。下列说法错误的是( )
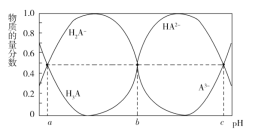
A.该温度下,H3A 的电离常数 Ka1=10a
B.若 b=7,加入 20 mL NaOH 溶液时,溶液的 pH<7
C.NaOH 溶液的体积为 30 mL 时,溶液中:c(OH)=3c(H3A)+2c(H2A)+c(HA2)+c(H+)
D.反应 2H2A![]() H3A+HA2在该温度下的平衡常数K=10a-b
H3A+HA2在该温度下的平衡常数K=10a-b
【答案】B
【解析】
由图像可知pH<a时,溶液中存在H3A和H2A-,且c(H3A)>c( H2A-),pH=a时,c(H3A)=c( H2A-),pH=b时c(HA2-)=c( H2A-),pH=c时c(HA2-)=c( A3-),结合溶液中电荷守恒、物料守恒和电离平衡常数进行分析计算。
A.电离常数只与温度有关,H3A的一级电离常数看图像左侧的第一个交点,故Ka1=c(H+),故A正确;
B.加入20 mL NaOH溶液时,溶液中的溶质为Na2HA,位于pH=b=7的右侧,此时溶液的pH>7,故B错误;
C.NaOH溶液的体积为30mL时,物料守恒表达式为![]() ,电荷守恒表达式为
,电荷守恒表达式为![]() ,两式联立可得题中表达式,故C正确;
,两式联立可得题中表达式,故C正确;
D.该反应在此温度下的平衡常数为![]() ,故D正确;
,故D正确;
故答案选:B。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是___(填元素符号)。
(2)②③⑦三种元素的原子半径从大到小的顺序为___(填元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式___,碱性最强的化合物的名称___。
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:___。
(5)元素⑥和⑦形成的气态氢化物较稳定是___(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实___(一个或两个方程式均可)。
(6)表示①与③形成的化合物的电子式___,写出它的一种用途___。