题目内容
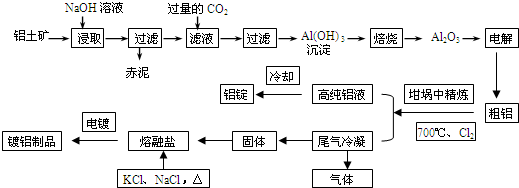
11.已知:Cu+2FeCl3=CuCl2+2FeCl2(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是FeCl3;
②Cu电极上发生的电极反应式为Cu-2e-=Cu2+;
③原电池工作时,盐桥中的K+(填“K+”或“Cl-”)不断进入X溶液中.
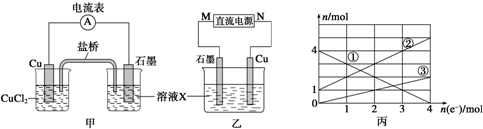
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是负极;
②图丙中的②线是Fe2+的变化.
③当电子转移为2mol时,溶解铜的质量为64g.
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点.
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O$\frac{\underline{\;电解\;}}{\;}$Na2FeO4+3H2↑,则电解时阳极的电极反应式是Fe+8OH--6e-═FeO42-+4H2O.
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.
③你认为高铁酸钠作为一种新型净水剂的理由可能是BC.
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质.
分析 (1)①氯化铁具有强氧化性,铜能被氯化铁氧化,所以电解质溶液为FeCl3溶液;
②Cu易失电子发生氧化反应而作负极;
③石墨作正极,则盐桥中阳离子向正极移动;
(2)根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算;
(3)①电解时阳极失电子发生氧化反应.
②铁失电子和氢氧根离子生成高铁酸根离子和水.
③高铁酸根离子有强氧化性,被还原生成的三价铁离子能发生生成胶体,胶体具有吸附性.
解答 解:(1)①氯化铁具有强氧化性,铜能被氯化铁氧化,所以反应为2FeCl3+Cu=CuCl2+2FeCl2,则FeCl3溶液为电解质溶液,故答案为:FeCl3;
②Cu作负极,失电子发生氧化反应,电极反应为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
③Cu作正极,放电时,电解质溶液中阳离子K+移向X溶液中,故答案为:K+;
(2)①根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,所以M是负极,故答案为:负;
②根据转移电子的物质的量和金属阳离子的物质的量的变化,可知①为Fe3+,②为Fe2+,③为Cu2+,故答案为:Fe2+;
③当电子转移为2mol时,溶液中有Fe3+ 2mol,Fe2+ 3mol,Cu2+为1mol,所以溶解铜的质量为64g,故答案为:64g;
(3)①电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O;
②NaClO氧化Fe(OH)3的反应方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
③高铁酸钠具有强氧化性,所以能杀菌消毒;高铁酸钠能被还原生成铁离子,铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附悬浮杂质,所以能净水,
故选BC.
点评 本题考查了电解原理和原电池原理,为高考热点问题,难点是(2)题图象分析,知道溶液中离子浓度变化及其原因,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | 甲胺(分子式CH3NH2)的沸点比三甲胺[分子式(CH3)3N]的沸点高 |
| A. | CHCl3是三角锥形 | |
| B. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 | |
| C. | AB2是V形,其A可能为sp2杂化 | |
| D. | NH4+是平面四边形结构 |
| A. | PCl5 | B. | P4 | C. | CCl4 | D. | NH3 |
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol•L-1):1.0 3.0 0.2
2s末浓度(mol•L-1):0.6 1.8 1.0
4s末浓度(mol•L-1):0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |
| A. | 容器内压强 | B. | 平均相对分子质量 | ||
| C. | 各组分浓度 | D. | 混合气体的颜色 |
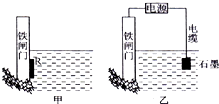 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$