题目内容
2.下列说法正确的是( )| A. | CHCl3是三角锥形 | |
| B. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 | |
| C. | AB2是V形,其A可能为sp2杂化 | |
| D. | NH4+是平面四边形结构 |
分析 A.甲烷分子中H原子被Cl原子取代生成CHCl3,根据甲烷结构确定CHCl3空间构型;
B.AB3型的共价化合物,其中心原子A可能采用sp2杂化;
C.AB2是V形,A可能是sp杂化,也可能是sp2杂化;
D.铵根离子中N原子价层电子对个数是4,所以铵根离子和甲烷结构相似.
解答 解:A.甲烷分子中H原子被Cl原子取代生成CHCl3,根据甲烷结构知CHCl3空间构型为四面体结构,故A错误;
B.AB3型的共价化合物,其中心原子A可能采用sp2杂化,如BF3,故B错误;
C.AB2是V形,A可能是sp杂化,也可能是sp2杂化,如SO2中S原子采用sp2杂化、CO2中C原子采用sp杂化,故C正确;
D.铵根离子中N原子价层电子对个数是4,所以铵根离子和甲烷结构相似,为正四面体结构,故D错误;
故选C.
点评 本题考查原子杂化方式判断及微粒空间构型判断,为高频考点,侧重考查学生分析判断能力,明确价层电子对互斥理论是解本题关键,难点是孤电子对个数计算方法,题目难度不大.

练习册系列答案
相关题目
12.120℃时,0.1mol两种气态烃组成的混合气体完全燃烧后得到8.8gCO2和3.6g水,则这两种烃可能是下列的( )
| A. | CH4和C3H4 | B. | C2H2和C2H6 | C. | CH4和C3H6 | D. | CH4和C2H6 |
13.向50gCuSO4溶液中放入一小块Na,待反应完全后,过滤,得到仍显蓝色的溶液44.6g,则投入的Na的质量为( )
| A. | 4.6g | B. | 4.1g | C. | 6.9 g | D. | 9.2g |
10.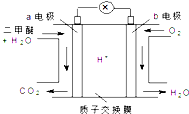 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上得电子,被氧化 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | 电池工作时,燃料电池内部H+从a电极移向b电极 |
17.下列氧化物中,能与水反应生成酸的是( )
| A. | SiO2 | B. | NO | C. | Al2O3 | D. | SO3 |
7.下列关于离子化合物的叙述不正确的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 有些离子化合物可能含有共价键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
14.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |