题目内容
1.25℃时,现有浓度均为0.10mol/L的两种溶液:①CH3COOH溶液、②NaOH溶液.请回答:(1)溶液①的pH>1(填“>”、“<”或“=”).
(2)写出CH3COOH 和NaOH溶液反应的离子方程式:CH3COOH+OH-=CH3COO-+H2O
(3)两溶液等体积混合后所得溶液显碱性,原因是CH3COO-+H2O?CH3COOH+OH-(用离子方程式表示).
(4)下列说法正确的是bc(填字母).
a.CH3COOH和 NaOH均属于弱电解质
b.CH3COOH和 NaOH均能抑制水的电离
c.若两溶液混合后pH<7,则溶液中离子浓度存在关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
分析 (1)醋酸是弱酸,不能完全电离;
(2)醋酸是弱酸,酸性离子方程式时不拆;
(3)在醋酸钠溶液中,醋酸钠根离子水解导致溶液显示碱性;
(4)a.弱酸、弱碱、水属于弱电解质,强酸强碱,大部分盐等属于强电解质;
b.酸和碱均能抑制水的电离;
c.若两溶液混合后pH<7,则溶液中醋酸的电离程度大于醋酸根离子的水解.
解答 解:(1)醋酸是弱酸,不能完全电离,0.10mol/L的CH3COOH溶液pH>1,故答案为:>;
(2)醋酸是弱酸,酸性离子方程式时不拆,所以CH3COOH 和NaOH溶液反应的离子方程式为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(3)两溶液等体积混合后所得溶液为醋酸钠溶液,在醋酸钠溶液中,醋酸钠根离子水解导致溶液显示碱性,即CH3COO-+H2O?CH3COOH+OH-,故答案为:CH3COO-+H2O?CH3COOH+OH-;
(4)a.醋酸属于弱电解质,氢氧化钠属于强电解质,故a错误;
b.酸和碱均能抑制水的电离,故b正确;
c.若两溶液混合后pH<7,则溶液混合后醋酸剩余,醋酸的电离程度大于醋酸根离子的水解程度,溶液中离子浓度存在关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故c正确.
故选bc.
点评 本题涉及弱电解质的电离、离子方程式书写、盐的水解以及溶液中离子浓度的大小关系比较等知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列元素中,属于第ⅠA族的是( )
| A. | Mg | B. | P | C. | Li | D. | S |
6.将标准状况下aL NH3溶解于1000g水中,得到氨水的物质的量浓度为b mol•L-1,则该氨水的密度为( )
| A. | $\frac{22.4b}{a}$g•cm-3 | B. | $\frac{22400+17ab}{17000a}$g•cm-3 | ||
| C. | $\frac{22400+17ab}{a}$ g•cm-3 | D. | $\frac{22400b+17ab}{1000a}$g•cm-3 |
13.下列分子中,所有原子不可能处于同一平面的是( )
| A. | CH2═CH2 | B. | CH3CH=CH2 | C. | 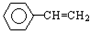 | D. | CO2 |
11.用相同体积的0.1mol•L-1的BaCl2溶液,能分别使相同体积的Fe2(SO4)3、ZnSO4、Na2SO4溶液的SO42-完全沉淀,则三种溶液的物质的量浓度之比为( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |