题目内容
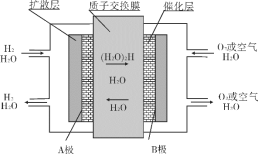
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

下列叙述正确的是( )
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O 4e– = O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
【答案】B
【解析】
用惰性电极电解硫酸钠溶液,相当于电解水,阳极氢氧根离子失电子生成氧气,溶液中氢离子浓度增大,硫酸根离子就要通过cd膜进入阳极区,生成硫酸,所以cd为阴离子交换膜;氢离子在阴极得电子生成氢气,溶液中氢氧根离子浓度增大,钠离子就要通过ab 膜进入阴极区,生成氢氧化钠,所以ab为阳离子交换膜;据以上分析进行解答。
A项,阴离子向阳极移动,氢氧根离子放电:4OH4e=O2↑+2H2O,溶液中氢离子浓度增大,pH减小,故A项错误;
B项,直流电场的作用下,两膜中间的Na+、SO42—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室,通电时,氢氧根离子在阳极区放电生成水和氧气,考虑电荷守恒,两膜中间的硫酸根离子会进入正极区,与氢离子结合成硫酸;氢离子在阴极得电子生成氢气,考虑电荷守恒,两膜中间的钠离子会进入负极区,与氢氧根离子结合成氢氧化钠,故可以得到NaOH和H2SO4产品,故B项正确;
C项,负极即为阴极,发生还原反应,氢离子得电子生成氢气,故C项错误;
D项,每生成1mol氧气转移4mol电子,当电路中通过1mol 电子的电量时,会有0.25mol的O2生成,故D项错误;
综上所述,本题选B。

 名校课堂系列答案
名校课堂系列答案