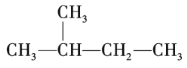题目内容
【题目】工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________,若所得硝酸密度为ρg/cm3,则其物质的量浓度为_______(保留两位小数)。
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为________m3(保留两位小数)。
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数_____________。
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。_____________
【答案】77.78%(或0.78) 12.35ρmol/L 47435.29 ![]() (或33.33%) 7:10
(或33.33%) 7:10
【解析】
1.设参加反应的氨气是4mol,则根据方程式4N2+5O2=4NO+6H2O、4NO+3O2+2H2O=4HNO可知NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为![]() =77.78%;根据c=
=77.78%;根据c=![]() 可知,若所得硝酸密度为ρg/cm3,则其物质的量浓度为
可知,若所得硝酸密度为ρg/cm3,则其物质的量浓度为![]() =12.35ρmol/L。
=12.35ρmol/L。
2.根据合成 NH4NO3的反应:NH3+ HNO3→NH4NO3
合成 80 t NH4NO3时,需要用 63 t HNO3吸收 17 t 的 NH3。
制备 63 t HNO3需要m(NH3)
NH3 ~ HNO3
17 63
m(NH3)×96%×92% 63 t
m(NH3)=19 t。
V(NH3)=![]() =47435.29(m3)
=47435.29(m3)
3.设NO x mol NO2 y mol N2O4 z mol
30 x + 46 y + 92z=2×28(x+ y + z)
![]() (x+y+z)=x +
(x+y+z)=x +![]() y +
y + ![]() z
z
X=y=z
则φ(NO2)=![]() (或33.33%)
(或33.33%)
4.设起始气体中CH4x mol 空气y mol,则N2为0.8y mol, O2为0.2y mol
CH4+2H2O→CO2+4H2①
2CH4+O2+2H2O→2CO2+6H2②
反应②生成的H2为0.2y mol×6/1=1.2y mol,消耗CH40.2y mol×2/1=0.4y mol
反应①生成的H2为(x-0.4y) mol×4/1=4(x-0.4y) mol
0.8 y : [1.2y +4(x-0.4y)]=1:3 x:y=7:10 V(CH4):V(空气)=7:10。