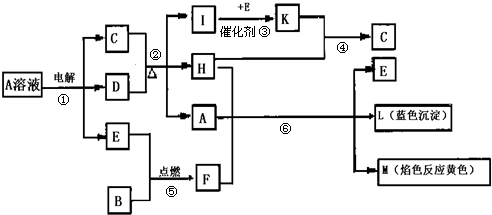
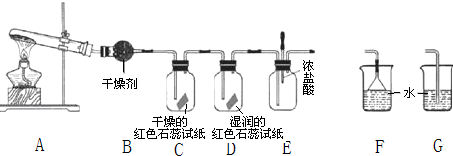
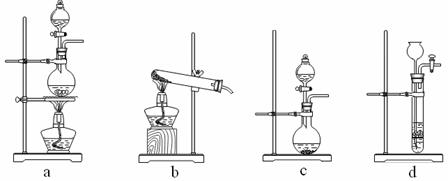
��Ŀ����
18������pH=2�Ĵ�����Һ��pH=2�������ң���������в����ش����⣺��1��ȡ10mL�ļ���Һ������������ˮ�����ƹ��壨����������ǰ����Һ������ֲ��䣩���������ܽ����Һ��$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$�ı�ֵ����С�����������С������ȷ��������
��2����ȡ25mL�ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�к���pH=7�������ĵ�NaOH��Һ�������С��ϵΪ��V����V�������������������=������
���� ��1��������м�������ƹ��壬��Һ�д��������Ũ���������ƴ�����룻
��2��pH��ȵĴ�������ᣬ�����Ũ�ȴ������ᣬ�������pH�������ᣬ��������ʵ����������ᣬ������ʵ���Խ����Ҫ��Ũ�ȵ�����������Һ���Խ��
��� �⣺��1��������м�������ƹ��壬��Һ�д��������Ũ���������ƴ�����룬��������Ũ�ȼ�С���������Ũ����������$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$��С���ʴ�Ϊ����С��
��2��pH��ȵĴ�������ᣬ�����Ũ�ȴ������ᣬ�������pH�������ᣬ��������ʵ����������ᣬ������ʵ���Խ����Ҫ��Ũ�ȵ�����������Һ���Խ��V���ף���V���ң����ʴ�Ϊ������
���� ���⿼����������ʵĵ��룬��ȷ������ʵ����ص��ǽⱾ��ؼ���ע����ͬŨ�ȵIJ�ͬ��ϡ��ʱ��pH�仯��С����ϵ���غ��������Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
8����״���£�22.4LCO2�����ʵ���Ϊ��������
| A�� | 0.20mol | B�� | 0.50mol | C�� | 1.0mol | D�� | 2.0mol |
3��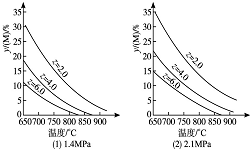 ��ӦaM��g��+bN��g��?cP��g��+dQ��g���ﵽƽ��ʱ��M���������y��M���뷴Ӧ�����Ĺ�ϵ��ͼ��ʾ������z��ʾ��Ӧ��ʼʱN�����ʵ�����M�����ʵ���֮�ȣ�����˵������ȷ���ǣ�������
��ӦaM��g��+bN��g��?cP��g��+dQ��g���ﵽƽ��ʱ��M���������y��M���뷴Ӧ�����Ĺ�ϵ��ͼ��ʾ������z��ʾ��Ӧ��ʼʱN�����ʵ�����M�����ʵ���֮�ȣ�����˵������ȷ���ǣ�������
 ��ӦaM��g��+bN��g��?cP��g��+dQ��g���ﵽƽ��ʱ��M���������y��M���뷴Ӧ�����Ĺ�ϵ��ͼ��ʾ������z��ʾ��Ӧ��ʼʱN�����ʵ�����M�����ʵ���֮�ȣ�����˵������ȷ���ǣ�������
��ӦaM��g��+bN��g��?cP��g��+dQ��g���ﵽƽ��ʱ��M���������y��M���뷴Ӧ�����Ĺ�ϵ��ͼ��ʾ������z��ʾ��Ӧ��ʼʱN�����ʵ�����M�����ʵ���֮�ȣ�����˵������ȷ���ǣ�������| A�� | ͬ��ͬѹͬzʱ�����������ƽ��ʱQ������������ı� | |
| B�� | ͬ��ͬѹʱ������z��ƽ��ʱQ���������һ������ | |
| C�� | ͬ��ͬzʱ������ѹǿ��ƽ��ʱQ���������һ����С | |
| D�� | ͬѹͬzʱ�������¶ȣ�ƽ��ʱQ���������һ������ |
7�����з�Ӧ��������Ϊ��������ǣ�������
| A�� | CH4��Cl2���� | B�� | ��ϩ�ڴ��������������ɾ���ϩ | ||
| C�� | ��ϩ���Ȼ���ӳ� | D�� | �������Cl2���� |
8��ij�����ŷŵķ�Һ�к����������������ͭ��С��ͬѧȡ������Һ����ʢ��һ����п�۵��ձ��У����裬����ַ�Ӧ����ˣ���������������Һ�����ڸ�ʵ�飬����˵����ȷ���ǣ�������
| A�� | �����ķ�Ӧ�����û���Ӧ | B�� | ʵ��������Һ�Ǵ�ˮ����ֱ���ŷ� | ||
| C�� | ������һ����ͭ��п | D�� | ��Ӧǰ��Һ������Լ�����pH��С |
 ����I2O5������CO��Ⱦ�����ⶨCO����ӦΪ��
����I2O5������CO��Ⱦ�����ⶨCO����ӦΪ��