题目内容
6.已知B是中学化学中常见的金属单质,E为地壳中含量最多的元素构成的单质,H常温下为无色液体,反应③、④是工业生产C的重要反应,C的浓溶液在加热时才与D反应.根据下列框图所示,试回答: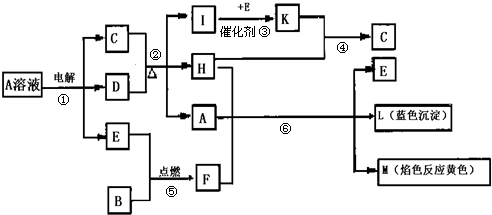
(1)反应②③④⑤⑥中属于氧化还原反应的是②③⑤⑥;
(2)反应①的化学方程式:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+2H2SO4+O2↑;
(3)写出C的浓溶液在加热时与D反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)F与A、H反应,当有7.8g F参加反应时转移的电子数目是6.02×1022.
分析 A的电解产物反应生成H,H常温下为无色液体,H为H2O;L是蓝色沉淀,为Cu(OH)2,M的焰色反应为黄色,M含有Na元素,由转化关系A+H+F→E+L+M,即A溶液+F→E+L+M,可知F与水反应生成碱与E,且B+E→F,故F为Na2O2,E为O2,B为金属Na,A为铜盐,由A溶液$\stackrel{电解}{→}$C+D+E可知,电解产物为三种,为放氧生酸型,电解生成Cu、O2、酸,C的浓溶液在加热时才与D反应,D为Cu,C为H2SO4,故A为CuSO4,由C+D$\stackrel{△}{→}$I+D+H可知,I为SO2,由I$\stackrel{E}{→}$K可知,K为SO3,SO3与水反应生成硫酸,验证符合转化关系.
解答 解:A的电解产物反应生成H,H常温下为无色液体,H为H2O;L是蓝色沉淀,为Cu(OH)2,M的焰色反应为黄色,M含有Na元素,由转化关系A+H+F→E+L+M,即A溶液+F→E+L+M,可知F与水反应生成碱与E,且B+E→F,故F为Na2O2,E为O2,B为金属Na,A为铜盐,由A溶液$\stackrel{电解}{→}$C+D+E可知,电解产物为三种,为放氧生酸型,电解生成Cu、O2、酸,C的浓溶液在加热时才与D反应,D为Cu,C为H2SO4,故A为CuSO4,由C+D$\stackrel{△}{→}$I+D+H可知,I为SO2,由I$\stackrel{E}{→}$K可知,K为SO3,SO3与水反应生成硫酸,验证符合转化关系.
(1)由上述分析可知,反应②为铜与浓硫酸的反应,是氧化还原反应,反应③为二氧化硫的催化氧化,是氧化还原反应,反应④为三氧化硫与水反应生成硫酸,是非氧化还原反应,反应⑤为钠在氧气中燃烧,是氧化还原反应,反应⑥为过氧化钠与水及硫酸铜的反应,是氧化还原反应,所以属于氧化还原反应的是②③⑤⑥,
故答案为:②③⑤⑥;
(2)反应①为电解硫酸铜溶液生成铜、硫酸、氧气,反应离子方程式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+2 H2SO4+O2↑,
故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+2 H2SO4+O2↑;
(3)铜 与浓硫酸加热生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)过氧化钠与水及硫酸铜的反应时,可以看作过氧化钠与水反应生成氢氧化钠和氧气,氢氧化钠与硫酸铜反应生成氢氧化铜,在过氧化钠与水的反应中,每摩尔过氧化钠反应可以转移1mol即6.02×1023个电子,所以7.8g 过氧化钠即为0.1mol参加反应时转移的电子数目是6.02×1022,
故答案为:6.02×1022.
点评 本题以无机框图题的形式考查Na、S、Cu等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写、硫酸工业等,难度较大,本题中L是蓝色沉淀,M的焰色反应为黄色,H常温下为无色液体以及A的电解等为解题突破口,根据L、M推断出F、E,再利用倒推法与顺推法向结合推断,对学生的逻辑推理能力提出较高要求.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 反应物A或B至少有一个是气体 | B. | 容器内不可能是单一气体 | ||
| C. | m+n可能大于p+q | D. | 若m<p,且D是气体,则B一定是气体 |
| A. | 陶瓷 | B. | 水泥 | C. | 玻璃 | D. | 涤纶 |
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g) △H=-192.9 kJ•mol-1,则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 |
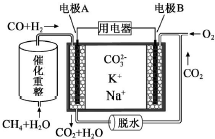 一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )| A. | 如用此种电池电镀铜,待镀铜金属上增重19.2g,则至少消耗标准状况下2.24L CH4 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
| A. | 能干燥氯气 | B. | 能使蔗糖炭化 | ||
| C. | 久置后浓度变大 | D. | 加热时能与碳反应 |
| A. | 硫酸铜溶液 | B. | 较浓稀硫酸 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |