题目内容
【题目】层状复合金属氢氧化物(简称“层状氢氧化物”),主体层板由二元(或多元)金属氢氧化物层构成,层间阴离子可以被其他阴离子取代,因此可以作为离子交换剂,在材料、化工、医药和环境保护等方面有着广泛的用途。镁铝碳酸根型水滑石是人们最早发现的层状氢氧化物。回答下列问题:
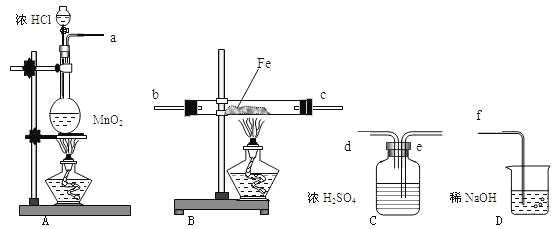
(1)下列状态的镁中,电离最外层一个电子所需能量最小的是___________(填标号)。
A. B.
B. C.
C.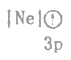 D.
D.
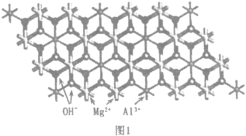
(2)一种水滑石的化学式为Mg4Al2(OH)12CO3H2O.其层板结构如图1。CO32-中碳的杂化类型是____。在图中最小的一个二维菱形晶胞(以图中Al为顶点)中含有___________个Al3+。每个镁氧八面体周围有_______________个相邻铝氧八面体和_______________个相邻镁氧八面体。
(3)水滑石中氢氧化物层的OH-和层间阴离子间的主要作用力为_______________,水滑石作为离子交换剂,去除水体中阴离子去除效果依次为:PO43->CrO42->NO3-,其原因是___________
(4)当加热到一定温度时,水滑石类化合物会发生分解,部分产物转化为尖晶石结构的MgxAlyOz,晶体结构如图2所示,它的化学式为___________;A块、B块均为边长为apm的立方体,设阿伏加德罗常数为NA,则最近的两个Al离子之间的距离为___________pm,密度为___________gcm-3(列出计算表达式)。

【答案】D sp2 1 3 3 氢键 阴离子带电荷越高,受到吸引力越强 MgAl2O4 ![]() a
a ![]()
【解析】
(1)根据电子排布图得出粒子状态,3p轨道的电子能量高于3s,第二电离能大于第一电离能,据此分析解答;
(2)计算CO32-中C原子的价电子对数和孤电子对数,判断C原子的杂化方式,结合侧板结构图分析各微粒个数;
(3)OH-和层间阴离子间可形成氢键,根据阴离子所带电荷与受到的吸引力之间的关系进行分析解答;
(4)利用均摊法计算晶胞中个原子的个数,利用公式![]() ,结合立体几何知识进行计算。
,结合立体几何知识进行计算。
(1)BC微粒都是Mg原子失去一个电子后得到的,但是C微粒能量高于B,稳定性B>C,所以失电子能量B>C;AD都是原子,但是A是基态、D是激发态,能量:D>A,稳定性A>D,所以失去一个电子能量:A>D;B为Mg+、A为Mg原子,B再失去电子所需能量就是Mg原子的第二电离能,A失去一个电子的能量是Mg原子的第一电离能,其第二电离能大于第一电离能,所以电离最外层一个电子所需能量B>A,因此,电离最外层一个电子所需能量最小的是D,故答案为:D。
(2)CO32-中C原子的价电子对数为![]() ,不含孤电子对,则其杂化类型为sp2杂化,在图1中,以图中Al为顶点,最小的一个二维菱形晶胞中含有1个Al3+。每个镁氧八面体周围有3个相邻铝氧八面体和3个相邻镁氧八面体,故答案为:sp2;1;3;3;
,不含孤电子对,则其杂化类型为sp2杂化,在图1中,以图中Al为顶点,最小的一个二维菱形晶胞中含有1个Al3+。每个镁氧八面体周围有3个相邻铝氧八面体和3个相邻镁氧八面体,故答案为:sp2;1;3;3;
(3)水滑石中的氢氧化物层的OH-和层间阴离子间可形成氢键,由于阴离子带电荷越高,受到吸引力越强,阴离子所带电荷数PO43->CrO42->NO3-,所以水滑石作为离子交换剂,去除水体中阴离子去除效果依次为:PO43->CrO42->NO3-,故答案为:氢键;阴离子带电荷越高,受到吸引力越强;
(4)根据晶胞结构示意图可知,O2-占据晶胞的顶点、面心、棱心和体心,其个数为![]() ,Mg2+位于晶胞的体内,个数为2,Al3+位于晶胞的体内、棱心和面心,其个数为
,Mg2+位于晶胞的体内,个数为2,Al3+位于晶胞的体内、棱心和面心,其个数为![]() ,因此其化学式为MgAl2O4,已知A块、B块均为边长为apm的立方体,则最近的两个Al离子之间的距离为
,因此其化学式为MgAl2O4,已知A块、B块均为边长为apm的立方体,则最近的两个Al离子之间的距离为 ,一个晶胞的质量
,一个晶胞的质量![]() ,体积V=2a3×10-30cm3,则密度
,体积V=2a3×10-30cm3,则密度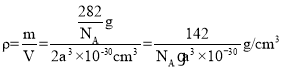 ,故答案为:
,故答案为:![]() 。
。