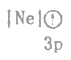题目内容
【题目】不能正确表示下列变化的离子方程式的是
A.MnO2与浓盐酸加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.FeCl2溶液在空气中变质:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
C.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
D.R-NH2电离:R-NH2+H2O![]() R-NH3++OH-
R-NH3++OH-
【答案】C
【解析】
因为电离常数:碳酸K1=4.4×10-7、K2=4.7×10-11;次氯酸K=2.9×10-8,因此酸性强弱为H2CO3>HClO>HCO3-,根据强酸制弱酸原理,离子方程式为:ClO- +CO2+ H2O=HClO + HCO3-,不发生 HCO3- + ClO-=HClO + CO32-,因为HClO的酸性强于HCO3-,不论少量或过量都一样。
A.MnO2与浓盐酸加热反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,A正确;
Mn2++Cl2↑+2H2O,A正确;
B.FeCl2溶液在空气中变质发生的离子方程式为:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓,B正确;
C.NaClO溶液中通入少量CO2,根据强酸制弱酸的原理,只发生离子方程式:ClO- +CO2+ H2O=HClO + HCO3-,不发生 HCO3- + ClO-=HClO + CO32-,不会生成CO32-,C错误;
D.R-NH2电离离子方程式为:R-NH2+H2O![]() R-NH3++OH-,D正确;答案选C。
R-NH3++OH-,D正确;答案选C。

【题目】根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质是一种淡黄色固体,是黑火药成分之一 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(i)元素Y的氢化物的电子式为____,其水溶液呈碱性的原因是(用电离方程式表示):____;
(ii)元素Z与元素T相比,非金属性较强的是___(填元素符号);
(iii)探寻物质的性质差异性是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___(填化学式)。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面元素有关的性质相符的曲线标号填入相应的空格中:
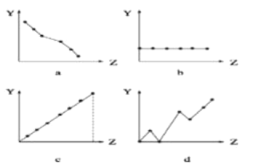
(i)IIA族元素的最外层电子数(填字母)____;
(ii)第三周期元素的最高化合价(填字母)____;
(iii)N3、O2、F、Na、Mg2、Al3的离子半径(填字母)___。
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
(i)氢化物的易燃性:第二周期___>__>H2O>HF,第三周期SiH4>PH3>___>___(填化学式);
(ii)化合物的毒性:PH3>NH3,H2S___H2O,CS2_CO2(选填“<”、“>”或“=”)。