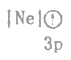题目内容
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A.2C+SiO2![]() 2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
B.1 mol NH3完全溶于水,则n(NH3·H2O)+n(NH4+)=l mol
C.氯化铝在气态时以双聚分子存在,其球棍模型为![]() ,则1 mol双聚分子中含有电子数为128NA
,则1 mol双聚分子中含有电子数为128NA
D.2SO2(g)+O2(g)2SO3(l) △H=-a kJ·mol-1(a>0),则每生成2 mol SO3(l)时吸热a kJ
【答案】C
【解析】
A. 2C+SiO2![]() 2CO↑+Si,无标准状况,不能求出4.48L CO的物质的量,A错误;
2CO↑+Si,无标准状况,不能求出4.48L CO的物质的量,A错误;
B. 1 mol NH3完全溶于水,含N的微粒有NH3·H2O、NH4+、NH3,根据物料守恒,n(NH3·H2O)+n(NH4+)+n(NH3)=l mol,B错误;
C. 氯化铝在气态时以双聚分子存在,其球棍模型为![]() ,则1mol双聚分子中含有2NA个Al,6NA个Cl,电子数为13×2NA+17×6NA=128 NA,C正确;
,则1mol双聚分子中含有2NA个Al,6NA个Cl,电子数为13×2NA+17×6NA=128 NA,C正确;
D. 2SO2(g)+O2(g)2SO3(l)△H=-a kJ·mol-1(a>0),是放热反应,每生成2mol SO3(l)时放热a kJ,D错误;
故选C。

练习册系列答案
相关题目