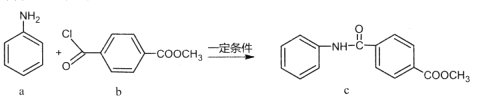
题目内容
【题目】实验题
化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生.
I.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水充足搅拌,过滤.
(1)往滤渣中加入过量NaOH溶液,过滤. 氢氧化铝与NaOH溶液反应的离子方程式是_______.
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.这一过程发生反应的化学方程式依次为:__________________________________,__________________________________.
II.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B,C中的反应物外,还有:_________.
(4)C中反应生成BaCO3的离子方程式是___________________________________.
(5)下列各项措施中,不能提高测定准确度的是(______)(填标号).
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A~B之间增添盛有浓硫酸的洗气装置
D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________.
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是_________________.
(8)装置中U形管D中的碱石灰的作用是_____________________________.
【答案】Al(OH)3+OH-=![]() +2H2O NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 Al(OH)3+3HCl=AlCl3+3H2O和NaHCO3+HCl=NaCl+CO2↑+H2O 把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收 Ba2++2OH-+CO2=BaCO3↓+H2O CD 25% B中水蒸气,氯化氢气体等进入C装置中(或其他合理答案) 防止空气中的CO2进入C
+2H2O NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 Al(OH)3+3HCl=AlCl3+3H2O和NaHCO3+HCl=NaCl+CO2↑+H2O 把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收 Ba2++2OH-+CO2=BaCO3↓+H2O CD 25% B中水蒸气,氯化氢气体等进入C装置中(或其他合理答案) 防止空气中的CO2进入C
【解析】
I. (1) 氢氧化铝与NaOH溶液反应生成偏铝酸钠与水;
(2) 往(1)所得滤液中先通入过量二氧化碳,生成Al(OH)3和NaHCO3,再加入过量稀盐酸会溶解Al(OH)3并和NaHCO3反应生成CO2;
II. (3) 实验通过C装置生成的碳酸钡的质量测定二氧化碳的质量,进而计算牙膏中碳酸钙的质量分数.装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小;
(4) 二氧化碳与氢氧化钡反应生成碳酸钡与水;
(6) BaCO3质量为3.94g,n(BaCO3)=0.0200mol,则n(CaCO3)=0.0200mol,质量为2.00g;
(7) B中的水蒸气、氯化氢气体等进入装置C中;
(8) 装置中U形管D中的碱石灰的作用防止空气中水蒸气、二氧化碳进入C影响测定结果。
I. (1) 氢氧化铝与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH-═AlO2-+2H2O;
(2) 往(1)所得滤液中先通入过量二氧化碳,发生反应NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再加入过量稀盐酸时发生反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O和NaHCO3+HCl=NaCl+CO2↑+H2O;
II. (3) 装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小,持续缓缓通入空气的作用为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收;
(4) 二氧化碳与氢氧化钡反应生成碳酸钡与水,反应方程式为CO2+Ba(OH)2═BaCO3↓+H2O,对应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O;
(5) A.在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故A错误;
B.滴加盐酸过快CO2,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故B错误;
C.在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故C正确;
D.在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置,可以吸收CO2中的HCl,生成二氧化碳,使二氧化碳增加,影响CO2,不能提高测定准确度,故D正确;
故答案为CD;
(6) BaCO3质量为3.94g,则n(BaCO3)=![]() =0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2g,所以样品中碳酸钙的质量分数为
=0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2g,所以样品中碳酸钙的质量分数为![]() ×100%=25% ;
×100%=25% ;
(7) B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高;
(8) 装置中U形管D中的碱石灰的作用防止空气中水蒸气、二氧化碳进入C影响测定结果,故答案为:防止空气中的水蒸气、CO2进入C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g) + 3H2(g) ![]() 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1 ________K2(填写“>”、“=”或“<”)
(2) 400℃时,反应2NH3(g) ![]() N2(g) + 3H2(g)的化学平衡常数的值为_____________。
N2(g) + 3H2(g)的化学平衡常数的值为_____________。
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) ___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中NH4+的浓度_______(填“增大”、“减小”或“不变”),其原因是_________________________________________________________。
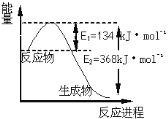
(6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 _____________________________________________。